O metanol (CH3OH) é um líquido incolor, inflamável e com odor adocicado. É usado como solvente, combustível e anticongelante. Pode ser tóxico se ingerido e causar cegueira ou morte.
| Nome IUPAC | Metanol |
| Fórmula molecular | CH4O |
| Número CAS | 67-56-1 |
| Sinônimos | Álcool metílico, álcool de madeira, hidroximetano, carbinol, nafta de madeira, álcool colonial |
| InChI | InChI=1S/CH4O/c1-2/h2H,1H3 |
Nota: InChI é uma cadeia longa que representa a estrutura única de uma molécula. Pode não ser renderizado corretamente em alguns dispositivos.
Propriedades do metanol
Massa molar do metanol
A massa molar do metanol é 32,04 g/mol. É calculado adicionando os pesos atômicos dos átomos de carbono, hidrogênio e oxigênio em uma única molécula de metanol. Este valor é útil para determinar a quantidade de metanol necessária para preparar uma determinada concentração de uma solução ou para determinar a estequiometria de uma reação química.
Ponto de ebulição do metanol
O metanol tem um ponto de ebulição de 64,7°C (148,46°F). Este ponto de ebulição relativamente baixo torna o metanol útil como solvente em diversas aplicações industriais, incluindo a produção de formaldeído, ácido acético e metacrilato de metila. No entanto, o baixo ponto de ebulição do metanol também o torna volátil e inflamável, o que pode representar riscos de segurança durante o armazenamento, manuseamento e transporte.
Ponto de fusão do metanol
CH3OH tem um ponto de fusão de -97,6°C (-143,68°F). Isto significa que o CH3OH é um líquido à temperatura ambiente, mas pode ser facilmente congelado na forma sólida, resfriando-o abaixo do seu ponto de fusão. O baixo ponto de fusão do CH3OH também é útil em algumas aplicações laboratoriais, como a preparação de solventes criogênicos para espectroscopia de ressonância magnética nuclear.
Densidade do metanol g/mL
A densidade do CH3OH é 0,792 g/mL a 20°C (68°F). Isto significa que o CH3OH é menos denso que a água e pode flutuar sobre ela. A densidade do CH3OH também pode ser usada para calcular o volume de CH3OH necessário para obter uma determinada massa ou concentração da solução.
Peso molecular do metanol
O peso molecular do CH3OH é 32,04 g/mol. Este valor é calculado adicionando os pesos atômicos dos átomos de carbono, hidrogênio e oxigênio em uma única molécula de CH3OH. O peso molecular do CH3OH é útil na determinação de suas propriedades físicas, como ponto de ebulição, ponto de fusão e densidade.
Estrutura do metanol
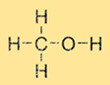
O metanol tem uma estrutura simples que consiste em um grupo metila (CH3) e um grupo hidroxila (-OH) ligados a um único átomo de carbono. A fórmula molecular do metanol é CH3OH. O metanol é uma molécula polar devido à presença do grupo hidroxila, o que o torna solúvel em solventes polares como água e etanol.
Fórmula de metanol
A fórmula química do metanol é CH3OH. Isto significa que cada molécula de metanol contém um átomo de carbono, quatro átomos de hidrogênio e um átomo de oxigênio. A fórmula do metanol pode ser usada para determinar o peso molecular e outras propriedades físicas do metanol. A fórmula química do metanol também é útil para escrever equações químicas e equilibrar reações químicas envolvendo metanol.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,792 g/ml a 20°C |
| Cor | Incolor |
| Cheiro | Doce, picante |
| Massa molar | 32,04 g/mol |
| Densidade | 0,792 g/ml a 20°C |
| Ponto de fusão | -97,6ºC |
| Ponto de ebulição | 64,7°C |
| Ponto flash | 11,1ºC |
| Solubilidade em Água | Miscível |
| Solubilidade | Miscível com etanol, éter, acetona e muitos solventes orgânicos |
| Pressão de vapor | 13,02kPa a 20°C |
| Densidade do vapor | 1,11 (ar = 1) |
| pKa | 15,5 |
| pH | 7 (neutro) |
Nota: Os valores listados nesta tabela são aproximados e podem variar dependendo das condições específicas e das fontes de metanol.
Segurança e perigos do metanol
CH3OH apresenta vários riscos de segurança e deve ser manuseado com cautela. É um líquido inflamável e pode inflamar-se se exposto ao calor, faíscas ou chamas. Os vapores de CH3OH também podem formar misturas explosivas com o ar. A inalação de vapores de CH3OH pode causar tonturas, dores de cabeça, náuseas e outros problemas de saúde. O CH3OH também é tóxico e pode ser absorvido pela pele ou ingerido, causando graves complicações de saúde, incluindo cegueira, coma e morte. É importante usar roupas de proteção e manusear o CH3OH em uma área bem ventilada e com equipamentos de segurança adequados, como óculos de proteção, luvas e respirador. Os derramamentos devem ser limpos imediatamente e descartados de maneira adequada.
| Símbolos de perigo | Caveira e Ossos Cruzados, Inflamável |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Use equipamento elétrico/de ventilação/iluminação à prova de explosão. Mantenha o recipiente bem fechado. Contêiner terrestre/esvaziado e equipamento de recebimento. Use apenas ferramentas que não produzam faíscas. Tome medidas preventivas contra descarga estática. Evite respirar vapores. Lave bem após o manuseio. Não coma, beba ou fume enquanto estiver usando este produto. |
| Identificadores AN | ONU1230 |
| Código SH | 29051100 |
| Classe de perigo | 3 |
| Grupo de embalagem | II |
| Toxicidade | O metanol é tóxico e pode causar cegueira, coma e morte se ingerido, inalado ou absorvido pela pele. Também pode causar irritação, vermelhidão e queimaduras ao contato. A exposição aos vapores de metanol pode causar dores de cabeça, tonturas, náuseas e outros problemas de saúde. O metanol deve ser manuseado com extremo cuidado e com equipamento de proteção adequado. |
Nota: Os valores listados nesta tabela são aproximados e podem variar dependendo das condições específicas e das fontes de metanol. É importante consultar a ficha de dados de segurança e as normas em vigor no manuseio do metanol.
Métodos de síntese de metanol
A oxidação direta do metano, a oxidação parcial do gás natural, a gaseificação do carvão e a síntese a partir do dióxido de carbono e do hidrogênio sintetizam metanol.
Um dos métodos mais comuns de síntese de metanol é converter cataliticamente o gás de síntese, que é uma mistura de monóxido de carbono, dióxido de carbono e hidrogênio. Este processo envolve a utilização de um catalisador, geralmente à base de cobre, para facilitar a reação. O gás de síntese é introduzido em um reator contendo o catalisador em altas temperaturas e pressões, resultando na produção de metanol.
Outro método de síntese de metanol envolve a oxidação direta do metano, que envolve o uso de altas temperaturas e pressões na presença de um catalisador como platina ou paládio. Este método é mais difícil e mais caro que o método do gás de síntese, mas é mais eficiente e pode produzir rendimentos mais elevados.
A oxidação parcial do gás natural é outro método de síntese de metanol, que envolve o uso de oxigênio ou ar para oxidar parcialmente o gás natural, produzindo uma mistura de monóxido de carbono e hidrogênio. A mistura é então introduzida em um reator contendo um catalisador, resultando na produção de metanol.
A gaseificação do carvão é outro método de síntese de metanol, que envolve a conversão do carvão em gás de síntese, seguido pelo mesmo processo de conversão catalítica descrito acima.
A captura e utilização de carbono convertem as emissões de dióxido de carbono dos processos industriais em metanol, utilizando o hidrogénio como agente redutor.
Usos do metanol
O metanol tem uma ampla gama de utilizações em diversas indústrias, incluindo:
- Combustível: Veículos, geradores e outros equipamentos industriais podem utilizar metanol como combustível.
- Solvente: O metanol é um excelente solvente para muitas substâncias, incluindo resinas, corantes e óleos. Os fabricantes usam metanol para produzir tintas, vernizes e outros revestimentos.
- Intermediário químico: utilizado como matéria-prima para a produção de formaldeído, ácido acético e outros produtos químicos.
- Anticongelante: Usado como agente anticongelante em sistemas de refrigeração de automóveis.
- Agente descongelante: Usado como agente descongelante para asas de aviões e pistas de aeroportos.
- Limpador: Utilizado como agente de limpeza em diversos processos industriais.
- Produtos farmacêuticos: Usado como solvente na produção de muitos produtos farmacêuticos.
- Energia alternativa: estudada como combustível alternativo para células de combustível e como potencial meio de armazenamento de energia.
- Metanol em Olefinas (MTO): Olefinas como etileno e propileno vêm da conversão de metanol.
- Metanol em Gasolina (MTG): Um processo chamado MTG converte metanol em gasolina.
Questões:
P: O que é metanol?
R: O metanol, também conhecido como álcool de madeira, é um líquido incolor, inflamável e com odor adocicado. É o álcool mais simples e sua fórmula química é CH3OH.
P: O metanol é polar ou apolar?
R: O metanol é uma molécula polar. Possui carga parcial positiva nos átomos de hidrogênio e carga parcial negativa no átomo de oxigênio, resultando em um momento dipolar.
P: Para que é usado o metanol?
R: O metanol tem uma ampla gama de usos em vários setores, inclusive como combustível, solvente, intermediário químico, anticongelante, agente de degelo, limpador, solvente farmacêutico e potencial meio de armazenamento de energia. Também é utilizado na produção de formaldeído, ácido acético e outros produtos químicos. Além disso, o metanol é convertido em olefinas como etileno e propileno, que são utilizadas como matéria-prima para a produção de plásticos.
