O fluorometano (CH3F) é um gás incolor com leve odor etéreo. É utilizado na produção de eletrônicos, produtos farmacêuticos e como refrigerante. Não é muito tóxico, mas constitui um poderoso gás de efeito estufa.
| Nome IUPAC | Fluorometano |
| Fórmula molecular | CH3F |
| Número CAS | 593-53-3 |
| Sinônimos | Fluoreto de metila, Freon 41, Halocarbono 41, R 41, ONU 2452 |
| InChI | InChI=1S/CH3F/c1-2/h1H3 |
Propriedades do fluorometano
Ponto de ebulição CH3F
O ponto de ebulição do CH3F é -78,4°C, que é relativamente baixo. Isso o torna um refrigerante ideal para diversas aplicações, como sistemas de refrigeração e ar condicionado. O CH3F também é usado como propelente em aerossóis devido ao seu baixo ponto de ebulição.
CH3F Massa molar
CH3F é um composto químico com a fórmula molecular CH3F. Também é conhecido como fluoreto de metila e tem massa molar de 34,03 g/mol. CH3F é um gás incolor com leve odor etéreo e é amplamente utilizado em diversas aplicações devido às suas propriedades únicas.
Ponto de fusão CH3F
O CH3F tem um ponto de fusão de -141°C, que também é relativamente baixo. Seu baixo ponto de fusão facilita o manuseio e o transporte, tornando-o uma escolha popular para diversas aplicações industriais. O baixo ponto de fusão do CH3F também o torna adequado para uso como refrigerante em aplicações de baixa temperatura.
Densidade CH3F
A densidade do CH3F é de 0,89 g/ml, o que é relativamente baixo. Isso o torna menos denso que o ar, que tem densidade de 1,29 g/ml. Como resultado, o CH3F é frequentemente usado como um gás mais leve que o ar em diversas aplicações, incluindo detecção de vazamentos, cromatografia gasosa e como gás de elevação para balões e dirigíveis.
Peso molecular de CH3F
O peso molecular do CH3F é 34,03 g/mol, o que é relativamente baixo. Isso o torna um composto leve, fácil de manusear e transportar. O CH3F é frequentemente utilizado na produção de produtos eletrônicos e farmacêuticos devido ao seu baixo peso molecular e propriedades únicas.
Estrutura do CH3F
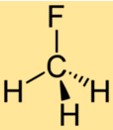
A estrutura do CH3F consiste em um único átomo de carbono ligado a três átomos de hidrogênio e um átomo de flúor. O átomo de flúor está ligado ao átomo de carbono, substituindo um dos átomos de hidrogênio no metano. A estrutura do CH3F torna-o um composto estável com propriedades químicas únicas.
Fórmula de Fluorometano
A fórmula do fluorometano é CH3F, que representa o arranjo dos átomos na molécula. A fórmula mostra que o fluorometano consiste em um átomo de carbono, três átomos de hidrogênio e um átomo de flúor. A fórmula é usada para descrever a composição química do fluorometano e é importante em diversas aplicações.
| Aparência | Gás incolor |
| Gravidade Específica | 0,89 a 20°C (ar = 1) |
| Cor | Incolor |
| Cheiro | Cheiro leve e etéreo |
| Massa molar | 34,03 g/mol |
| Densidade | 0,89g/ml |
| Ponto de fusão | -141ºC |
| Ponto de ebulição | -78,4ºC |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 0,5 g/L a 20°C |
| Solubilidade | Miscível em solventes orgânicos |
| Pressão de vapor | 4,4 bares a 20°C |
| Densidade do vapor | 1,43 (ar = 1) |
| pKa | 50,9 |
| pH | Não aplicável |
Segurança e perigos do fluorometano
O fluorometano é geralmente considerado um composto seguro de manusear e usar, de baixa toxicidade e não inflamável. No entanto, como qualquer produto químico, apresenta perigos potenciais e considerações de segurança. A exposição a altas concentrações de fluorometano pode causar tonturas, dores de cabeça e náuseas. É também um poderoso gás com efeito de estufa que contribui para as alterações climáticas. O fluorometano deve ser manuseado em uma área bem ventilada e devem ser usados equipamentos de proteção, como luvas e óculos de proteção. É importante seguir os procedimentos adequados de armazenamento e manuseio para evitar vazamentos e liberações acidentais no meio ambiente.
| Símbolos de perigo | F+ |
| Descrição de segurança | Gás altamente inflamável; Tóxico por inalação; Causa irritação na pele; Causa irritação ocular grave; Pode causar sonolência ou tonturas; Pode causar danos aos órgãos |
| Identificadores AN | UN2452 |
| Código SH | 2903.49.90 |
| Classe de perigo | 2.1 |
| Grupo de embalagem | II |
| Toxicidade | Baixa toxicidade, mas pode causar efeitos à saúde se inalado em altas concentrações. |
Métodos de síntese de fluorometano
Vários métodos, incluindo fluoração direta do metano e reações de troca de halogênio, podem sintetizar fluorometano.
Um método comum é a reação do metanol com fluoreto de hidrogênio na presença de um catalisador, como óxido de alumínio ou fluoreto de alumínio.
Outro método envolve a reação de clorometano ou bromometano com gás fluoreto de hidrogênio. Ambos os métodos produzem fluorometano como subproduto, que pode então ser separado e purificado por destilação ou outros métodos.
Outro método de síntese de fluorometano envolve a reação de fluorofórmio e cloreto de hidrogênio na presença de um catalisador, como zinco ou cobre. Esta reação produz uma mistura de clorofluorometano e fluorometano, que pode ser separada e purificada por destilação.
Usos do Fluorometano
O fluorometano tem vários usos em diversas indústrias, incluindo:
- Refrigeração: Utilizado como refrigerante em sistemas de refrigeração industrial e comercial devido ao seu baixo ponto de ebulição e não inflamabilidade.
- Eletrônicos: Usado como agente de limpeza para componentes eletrônicos e como agente de gravação de plasma na indústria de semicondutores.
- Aplicações médicas: Utilizado como anestésico na medicina veterinária devido à sua baixa toxicidade e ação rápida.
- Produção de pesticidas: Utilizado como precursor na produção de certos pesticidas, incluindo herbicidas e inseticidas.
- Produção de polímeros: utilizado como agente de expansão na produção de espumas poliméricas, como espuma de poliuretano.
- Aplicações laboratoriais: Usado como solvente e reagente em diversas aplicações laboratoriais, incluindo síntese e análise química.
- Supressão de Incêndio: Também utilizado como agente de supressão de incêndio em certos tipos de extintores de incêndio, principalmente aqueles utilizados em salas de informática e telecomunicações.
Questões:
P: O CH3F é polar ou apolar?
R: CH3F é uma molécula polar devido ao arranjo assimétrico dos átomos de flúor e hidrogênio em torno do átomo de carbono central, resultando em um momento dipolar líquido.
P: O CH3F tem uma ligação de hidrogênio?
R: O fluorometano não possui ligação de hidrogênio porque não contém um átomo de hidrogênio ligado a um elemento altamente eletronegativo, como nitrogênio, oxigênio ou flúor.
P: Qual composto tem as forças intermoleculares mais fortes: HF, CH3Cl, CH3F, HCl?
R: O HF tem as forças intermoleculares mais fortes devido à sua capacidade de formar ligações de hidrogênio, que são mais fortes do que as forças dipolo-dipolo de outros compostos.
P: Qual tem as forças dipolo-dipolo mais fracas: N2, CO, CH3F, HCl?
R: O N2 tem as forças dipolo-dipolo mais baixas porque é uma molécula apolar e, portanto, não possui momento dipolar líquido. CO, CH3F e HCl são moléculas polares e possuem forças dipolo-dipolo, mas a força dessas forças aumenta na ordem HCl <CH3F <CO devido ao aumento da polaridade das moléculas.
