Carbonato de sódio ou carbonato de sódio é um composto inorgânico com a fórmula química Na2CO3. É um sal alcalino, de cor branca e solúvel em água. É utilizado em diversos processos industriais e comerciais, como na fabricação de vidros, papéis, sabões, detergentes e produtos de limpeza.
| Nome IUPAC | Carbonato de Sódio |
| Fórmula molecular | Na2CO3 |
| Número CAS | 497-19-8 |
| Sinônimos | Na2CO3 anidro, Na2CO3 decaidratado, refrigerante, carbonato de sódio |
| InChI | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Propriedades do carbonato de sódio
Massa molar de carbonato de sódio
A massa molar do carbonato de sódio é 106,0 g/mol. É a soma das massas atômicas de todos os átomos de uma molécula de carbonato de sódio. A massa molar é uma propriedade física importante usada em muitos cálculos em química e outras ciências.
Ponto de ebulição do carbonato de sódio
O carbonato de sódio tem um ponto de ebulição de 1600°C. Esta é a temperatura na qual a pressão de vapor do líquido se iguala à pressão da atmosfera circundante e o líquido ferve. O ponto de ebulição é uma propriedade útil para identificar e separar diferentes compostos.
Ponto de fusão do carbonato de sódio
O Na2CO3 tem um ponto de fusão de 851°C. Esta é a temperatura na qual a forma sólida do composto se transforma em líquido. O ponto de fusão é uma propriedade importante utilizada na identificação e purificação de diferentes substâncias.
Densidade de Carbonato de Sódio g/mL
O Na2CO3 tem uma densidade de 2,54 g/mL. A densidade é definida como a massa por unidade de volume de uma substância e é uma propriedade útil para determinar a concentração de uma solução.
Peso molecular do carbonato de sódio
O peso molecular do carbonato de sódio é 106 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula. O peso molecular é uma propriedade importante usada em muitos cálculos em química e outras ciências.
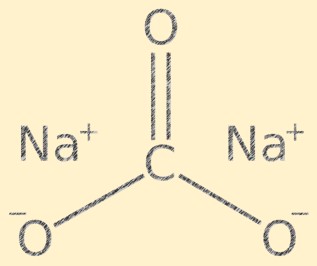
Estrutura do carbonato de sódio
O Na2CO3 possui estrutura cristalina e é composto por cátions de sódio (Na+) e ânions carbonato (CO3-). O íon carbonato tem forma trigonal plana, com o átomo de carbono no centro e os átomos de oxigênio ligados a ele em um ângulo de 120 graus. Os íons sódio e os íons carbonato são mantidos juntos por ligações iônicas, dando ao composto sua estrutura cristalina característica.
| Aparência | Pó cristalino branco ou pequenos cristais brancos |
| Gravidade Específica | 2,54g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 106,0 g/mol |
| Densidade | 2,54g/ml |
| Ponto de fusão | 851°C |
| Ponto de ebulição | 1600°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em glicerol, ligeiramente solúvel em etanol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | 10.3 |
| pH | 11,6 (solução 1M) |
Segurança e perigos do carbonato de sódio
O carbonato de sódio é um composto básico e pode causar irritação na pele e nos olhos. A inalação do seu pó pode causar irritação respiratória. Também é prejudicial se ingerido e pode causar problemas digestivos. O manuseio deve ser realizado com luvas e óculos de proteção, e a substância deve ser armazenada em local fresco e seco, longe de fontes de ignição. Evite ingerir ou inalar o pó e lave bem após o manuseio.
| Símbolos de perigo | XI,N |
| Descrição de segurança | Irritante |
| Números de identificação da ONU | Um 1824 |
| Código SH | 2836.90.90 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | LD50 oral (rato) = 915 mg/kg. CL50 por inalação (rato) = >10 mg/L/4h. Pode causar irritação na pele e nos olhos e no trato respiratório se inalado. Pode ser perigoso se engolido. |
Métodos para a síntese de carbonato de sódio
O carbonato de sódio pode ser sintetizado por dois métodos principais: o processo Solvay e o método de precipitação. O processo Solvay, também conhecido como processo amônia-soda, envolve a reação de cloreto de sódio, amônia e dióxido de carbono para produzir carbonato de sódio, cloreto de amônio e água. O método de precipitação envolve a reação de hidróxido de sódio e dióxido de carbono para produzir carbonato de sódio e água. Ambos os métodos resultam em um produto de alta pureza que pode ser usado para diversas aplicações, como tratamento de água, fabricação de sabão e detergente e produção de vidro. O processo Solvay é o método mais comumente utilizado devido ao seu menor custo de produção e maior rendimento de produção.
Usos do carbonato de sódio
As indústrias utilizam carbonato de sódio ou refrigerante, para diversos fins. A indústria de detergentes o utiliza como amaciante de água e ajustador de pH, a indústria do vidro o utiliza para criar vidro plano, vidro para embalagens e vidros especiais, e a indústria do papel o utiliza para neutralizar fluxos de resíduos ácidos e ajustar o pH. Na indústria química, o carbonato de sódio é um ingrediente chave na produção de silicatos e bicarbonatos de sódio. Também serve como aditivo alimentar e agente de limpeza em caldeiras e processos de tratamento de água na indústria alimentícia. Além disso, o carbonato de sódio desempenha um papel na produção de corantes, esmaltes, cerâmicas e atua como extintor em extintores.
