O carbonato de magnésio (MgCO3) é uma substância em pó branco comumente usada como antiácido e laxante. Também é encontrado em certos cosméticos e cremes dentais. O carbonato de magnésio ajuda a neutralizar o excesso de ácido estomacal e a aliviar a constipação.
| Nome da IUPAC | Carbonato de Magnésio |
| Fórmula molecular | MgCO3 |
| Número CAS | 546-93-0 |
| Sinônimos | Magnesita, Magnésia carbonica, sal de magnésio, (MgCO3) |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Propriedades do carbonato de magnésio
Fórmula de Carbonato de Magnésio
A fórmula química do carbonato de magnésio é MgCO3. Esta fórmula indica que o carbonato de magnésio contém um íon Mg+2 e um íon CO3 2-. O íon CO3 2 é composto por um átomo de C e três átomos de O. A fórmula química do carbonato de magnésio é uma propriedade importante porque identifica a composição do carbonato de magnésio e seus elementos constituintes.
Massa molar de carbonato de magnésio
A massa molar do MgCO3 é 84,31 g/mol. Este valor é obtido somando as massas atômicas dos átomos de magnésio, carbono e oxigênio em um mol de MgCO3. A massa molar é uma propriedade física importante do MgCO3 porque é usada em vários cálculos, como na determinação do número de moles de MgCO3 em uma determinada amostra.
Ponto de ebulição do carbonato de magnésio
O MgCO3 não tem ponto de ebulição definido porque se decompõe antes de atingir o ponto de ebulição. Quando aquecido, o MgCO3 se decompõe formando óxido de magnésio e dióxido de carbono. A decomposição do MgCO3 ocorre a uma temperatura de aproximadamente 350°C.
Ponto de fusão do carbonato de magnésio
O ponto de fusão do MgCO3 é 990°C. A esta temperatura, o MgCO3 derrete e sofre decomposição para formar óxido de magnésio e dióxido de carbono. O ponto de fusão do MgCO3 é uma propriedade física importante porque determina a temperatura na qual o MgCO3 pode ser fundido e processado.
Densidade de Carbonato de Magnésio g/mL
A densidade do MgCO3 é 2,958 g/mL. Este valor é obtido dividindo a massa de um mol de MgCO3 pelo seu volume. A densidade do MgCO3 é uma propriedade física importante porque é usada em diversas aplicações, como a determinação da flutuabilidade do MgCO3 em uma determinada solução.
Peso molecular do carbonato de magnésio
O peso molecular do MgCO3 é 84,31 g/mol. Este valor é obtido somando as massas atômicas dos átomos de magnésio, carbono e oxigênio em uma molécula de MgCO3. O peso molecular do MgCO3 é uma propriedade física importante porque é usado em vários cálculos, como na determinação da quantidade de MgCO3 necessária para uma determinada reação química.
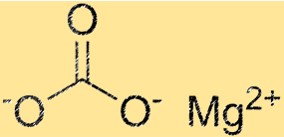
Estrutura do carbonato de magnésio
O MgCO3 possui uma estrutura cristalina trigonal. O íon magnésio está localizado no centro da estrutura e é cercado por seis íons carbonato. Os íons carbonato estão dispostos em um padrão hexagonal ao redor do íon magnésio. A estrutura cristalina do MgCO3 é uma propriedade importante porque determina suas propriedades físicas e químicas.
| Aparência | Sólido branco |
| Densidade específica | 2.958g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 84,31 g/mol |
| Densidade | 2.958g/ml |
| Ponto de fusão | 990°C |
| Ponto de ebulição | Decompõe-se antes de atingir o ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,02g/L (15°C) |
| Solubilidade | Solúvel em ácidos, insolúvel em água |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 10.3 |
| pH | 9,2-10,2 |
Segurança e perigos do carbonato de magnésio
O MgCO3 é considerado um composto seguro. Não é inflamável, explosivo ou tóxico. Porém, como qualquer outro composto químico, deve ser manuseado com cuidado. A inalação de pó de MgCO3 pode causar irritação respiratória. Ao manusear MgCO3, recomenda-se o uso de equipamentos de proteção individual adequados, como luvas e óculos de segurança. O MgCO3 deve ser armazenado em local fresco e seco, longe de fontes de calor e ignição. O MgCO3 derramado deve ser limpo imediatamente e descartado adequadamente. É importante seguir as precauções de segurança adequadas ao manusear o MgCO3 para evitar quaisquer perigos potenciais.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Não classificado como perigoso |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2836.60.00 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade, não considerada um risco significativo à saúde quando manuseada adequadamente |
Métodos de síntese de carbonato de magnésio
Existem vários métodos para sintetizar MgCO3, incluindo precipitação e decomposição térmica.
Para formar MgCO3 usando o método de precipitação, você adiciona um sal de magnésio solúvel (como cloreto de magnésio ou nitrato de magnésio) a uma solução contendo um carbonato solúvel (como carbonato de sódio ou nitrato de magnésio). carbonato de amônio). Em seguida, mexa a mistura resultante e deixe descansar. Isso faz com que o MgCO3 precipite da solução. Em seguida, filtre o precipitado, lave e seque.
Para obter MgCO3 pelo método de decomposição térmica, o hidróxido de magnésio ou óxido de magnésio é aquecido enquanto se introduz dióxido de carbono. Esta reação leva à formação de MgCO3 e vapor d’água. O próximo passo é coletar, purificar e secar o MgCO3.
Outro método para sintetizar MgCO3 é reagir sulfato de magnésio e carbonato de sódio . A água dissolve os dois compostos e depois os mistura, fazendo com que o MgCO3 precipite da solução. O processo então coleta, lava e seca o precipitado.
Usos do carbonato de magnésio
O MgCO3 é um composto versátil com diversas utilizações em diferentes indústrias. Aqui estão alguns de seus usos:
- Suplemento alimentar: Utilizado como suplemento alimentar devido à sua capacidade de fornecer ao corpo o magnésio essencial.
- Antiácido: Usado como antiácido para tratar azia e indigestão.
- Aplicações Industriais: Utilizado em diversas aplicações industriais, como na produção de cerâmica, vidro e cimento.
- Cosméticos: Utilizado em cosméticos como agente inchador, absorvente e opacificante.
- Retardador de chama: Usado como retardador de chama em diversas aplicações, incluindo materiais de isolamento, têxteis e plásticos.
- Farmacêuticos: Utilizados na produção de diversos produtos farmacêuticos, como laxantes e antiácidos.
- Indústria alimentar: Utilizado como aditivo alimentar para regular a acidez dos produtos alimentares e como agente antiaglomerante.
- Equipamentos esportivos: utilizados em equipamentos esportivos, como giz de ginástica, para melhorar a aderência e evitar escorregões.
Questões:
P: O carbonato de magnésio é solúvel em água?
R: O MgCO3 tem baixa solubilidade em água. À temperatura ambiente, apenas cerca de 0,02 gramas de MgCO3 podem dissolver-se em 100 ml de água.
P: O MgCO3 é solúvel?
R: O MgCO3 tem baixa solubilidade em água, o que significa que não é muito solúvel.
P: O que é formado quando o ácido acético e o MgCO3 reagem?
R: Quando o ácido acético e o MgCO3 reagem, eles formam acetato de magnésio, água e dióxido de carbono. A equação química balanceada para esta reação é MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
Q: A solubilidade molar do MgCO3 é 1,8 × 10–4 mol/L. Qual é o Ksp para este composto?
A: Valor Ksp para MgCO3 usando solubilidade molar:
Ksp = [Mg2+][CO32-], onde [Mg2+] é igual à solubilidade molar e [CO32-] também é igual à solubilidade molar. Portanto, Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
P: Qual dos seguintes é um produto formado durante a decomposição do MgCO3?
R: Quando o MgCO3 se decompõe, forma óxido de magnésio (MgO) e dióxido de carbono (CO2).
P: Qual é a equação química balanceada para a reação usada para calcular ΔH°f de MgCO3(s)?
R: A equação química balanceada da reação usada para calcular a entalpia padrão de formação (ΔH°f) de MgCO3(s) é: Mg(s) + CO2(g) → MgCO3(s).
