Carbonato de cobre (CuCO3) é um composto azul esverdeado formado naturalmente pela reação de sais de Cu com íons carbonato. Possui diversas aplicações industriais, incluindo pigmentos e fungicidas.
| Nome IUPAC | Carbonato de cobre (II) |
| Fórmula molecular | CuCO3 |
| Número CAS | 1184-64-1 |
| Sinônimos | Carbonato de cobre básico, Carbonato cúprico, Monocarbonato de cobre |
| InChI | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Propriedades do carbonato de cobre
Fórmula de Carbonato de Cobre
A fórmula química do carbonato cúprico é CuCO3. Representa uma combinação de um átomo de cobre (Cu), um átomo de carbono (C) e três átomos de oxigênio (O). Esta fórmula fornece informações cruciais sobre a composição elementar do composto.
Massa molar de carbonato de cobre
O carbonato cúprico tem uma massa molar de aproximadamente 123,55 gramas por mol (g/mol). A massa molar é a soma das massas atômicas de todos os átomos presentes em um mol de substância e é expressa em gramas por mol.
Ponto de ebulição do carbonato de cobre
O carbonato cúprico não tem um ponto de ebulição distinto, uma vez que se decompõe em CuO e dióxido de carbono quando aquecido a cerca de 200°C. Portanto, sofre decomposição térmica em vez de ferver.
Ponto de fusão do carbonato de cobre
O carbonato cúprico tem um ponto de fusão de aproximadamente 200°C (392°F). A esta temperatura, o carbonato cúprico sólido passa para o estado líquido. No entanto, deve-se notar que ele se decompõe antes de atingir o ponto de ebulição.
Densidade de Carbonato de Cobre g/mL
A densidade do carbonato cúprico é de aproximadamente 3,6 gramas por mililitro (g/mL). A densidade mede a massa de uma substância por unidade de volume, indicando o quão próximas suas partículas estão compactadas.
Peso molecular do carbonato de cobre
O peso molecular do carbonato cúprico, também chamado de massa molar, é de aproximadamente 123,55 g/mol. Este valor é crucial para vários cálculos e conversões químicas.
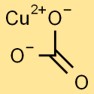
Estrutura do carbonato de cobre
O carbonato cúprico adota uma estrutura trigonal planar. O átomo central de cobre é cercado por três átomos de oxigênio e um grupo carbonato, composto por um átomo de carbono e três átomos de oxigênio ligados entre si.
Solubilidade do carbonato de cobre
O carbonato cúprico é pouco solúvel em água, o que significa que se dissolve apenas até certo ponto. A solubilidade é afetada por fatores como temperatura e pH. Reage com ácidos para formar sais de cobre e liberar dióxido de carbono.
| Aparência | Sólido azul esverdeado |
| Gravidade Específica | ~3,6g/ml |
| Cor | Azul verde |
| Cheiro | Inodoro |
| Massa molar | ~123,55 g/mol |
| Densidade | ~3,6g/ml |
| Ponto de fusão | ~200°C (392°F) |
| Ponto de ebulição | Decompõe-se a ~200°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Pouco solúvel, afetado pela temperatura e pH |
| Solubilidade | Insolúvel na maioria dos solventes |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino (básico) |
Segurança e perigos do carbonato de cobre
O carbonato cúprico apresenta certas considerações de segurança e perigo. É essencial manuseá-lo com cuidado para evitar riscos potenciais. O contato direto com a pele, olhos ou inalação de poeira pode causar irritação e desconforto. A exposição ou ingestão prolongada pode ser prejudicial e causar problemas de saúde mais graves. Pode liberar vapores tóxicos, incluindo dióxido de carbono, quando aquecido, necessitando de ventilação adequada. Além disso, o carbonato cúprico é inflamável na forma de pó, exigindo armazenamento e manuseio cuidadosos para evitar riscos de incêndio. Para garantir a segurança, siga sempre as precauções de segurança, use equipamento de proteção adequado e armazene os compostos longe de materiais incompatíveis.
| Símbolos de perigo | Irritante, Perigoso |
| Descrição de segurança | Manuseie com cuidado. Evite contato direto. Use em áreas bem ventiladas. Siga as instruções de segurança e use equipamento de proteção. |
| Números de identificação da ONU | Não atribuído |
| Código SH | 2836.40.0000 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade; pode causar irritação e desconforto ao contato; evite ingestão e inalação. |
Métodos de síntese de carbonato de cobre
Existem vários métodos para sintetizar carbonato cúprico, todos envolvendo a combinação de sais de Cu com fontes de carbonato. Uma abordagem comum é reagir CuSO4 com carbonato de sódio (Na2CO3) em solução aquosa. Esta reação produz um precipitado de carbonato cúprico, que é separado por filtração, seguido de secagem para obtenção do produto sólido.
Outro método envolve a reação de CuCl2 com carbonato de sódio ou bicarbonato de sódio (NaHCO3) em ambiente aquoso semelhante. Esta reação produz carbonato cúprico e cloreto de sódio (NaCl) como subproduto.
Além disso, borbulhar dióxido de carbono (CO2) através de uma solução de Cu(OH)2 forma um precipitado de carbonato cúprico após a conversão de hidróxido.
O metal Cu interage com o gás dióxido de carbono em um ambiente controlado para produzir carbonato cúprico.
O controle das condições de reação, como temperatura e concentração, torna-se crucial para alcançar os rendimentos e a pureza desejados. Esses métodos fornecem meios para produzir carbonato cúprico para diversas aplicações industriais, incluindo seu uso como pigmento, fungicida ou em outros processos químicos.
Usos do carbonato de cobre
O carbonato de cobre encontra aplicações versáteis em diversas indústrias devido às suas propriedades únicas. Aqui estão alguns usos principais do carbonato cúprico:
- Pigmentos: O carbonato cúprico confere amplamente tons vibrantes de azul esverdeado a tintas, cerâmicas e plásticos, melhorando sua aparência.
- Fungicida Agrícola: Serve efetivamente como fungicida na agricultura, protegendo as plantações de infecções fúngicas e promovendo o crescimento saudável das plantas.
- Preservação de madeira: O carbonato de cobre é usado em formulações de preservação de madeira, protegendo a madeira do apodrecimento e de danos causados por insetos.
- Galvanoplastia: Facilita crucialmente os processos de galvanoplastia, permitindo a deposição de um revestimento de cobre em diversas superfícies metálicas, melhorando assim a condutividade e a resistência à corrosão.
- Catalisador: O carbonato cúprico atua como um catalisador ativo em diversas reações químicas, acelerando as taxas de reação sem sofrer alterações significativas.
- Algicida: No tratamento de água, funciona ativamente como algicida, controlando o crescimento de algas em tanques, lagoas e sistemas de água.
- Fabricação de vidro: O carbonato de cobre contribui ativamente para a produção de produtos de vidro verde, como garrafas e artigos de vidro decorativos, na indústria de fabricação de vidro.
- Joias Artificiais: A produção de joias artificiais incorpora ativamente carbonato cúprico, fornecendo uma alternativa acessível às joias reais à base de cobre.
- Química analítica: o carbonato de cobre encontra uso ativo como reagente em química analítica para conduzir vários testes e experimentos.
- Fogos de artifício e pirotecnia: Contribui ativamente para a cor verde brilhante dos fogos de artifício e shows pirotécnicos.
A diversidade de aplicações destaca a importância do carbonato cúprico como um composto químico valioso em muitas indústrias, melhorando produtos e processos.
Questões:
P: Quantos moles de átomos de oxigênio existem em 5,67 moles de carbonato de cobre (II)?
R: Em 5,67 moles de carbonato de cobre (II), existem 17,01 moles de átomos de oxigênio (3 átomos de oxigênio para 1 mol de CuCO3).
P: O carbonato de cobre é solúvel?
R: O carbonato cúprico é pouco solúvel em água.
P: Qual elemento tem maior probabilidade de transmitir eletricidade: cobre, carbono, hélio ou enxofre?
R: O cobre é o elemento com maior probabilidade de transmitir eletricidade porque é um bom condutor de eletricidade.
P: Como fazer carbonato de cobre?
R: O carbonato cúprico pode ser preparado pela reação de sais de Cu com fontes de carbonato, como carbonato de sódio, ou borbulhando dióxido de carbono através de uma solução de Cu(OH)2.
P: Como usar carbonato de cobre em cerâmica?
R: O carbonato cúprico é usado em cerâmica como esmalte cerâmico para adicionar uma cor azul esverdeada às peças acabadas.
P: O CuCO3 é solúvel em água?
R: CuCO3 é pouco solúvel em água.
P: Como você poderia usar uma reação de precipitação para preparar uma amostra de CuCO3?
R: Para preparar CuCO3 por uma reação de precipitação, você pode misturar um sal solúvel de Cu com um sal carbonato solúvel, levando à formação de carbonato cúprico insolúvel, que pode ser separado por filtração.
P: Qual é o nome do composto CuCO3?
R: O composto CuCO3 é denominado carbonato cúprico (II).
P: Qual é a massa molar do CuCO3?
R: A massa molar do CuCO3 é aproximadamente 123,55 g/mol.
P: O CuCO3 é solúvel ou insolúvel?
R: CuCO3 é insolúvel na maioria dos solventes, incluindo água.
P: Do que é feito o carbonato de cobre (II)?
R: O carbonato de cobre (II) é composto por um átomo de Cu, um átomo de carbono (C) e três átomos de oxigênio (O).
