O carbonato de cálcio é um composto químico com a fórmula CaCO3. É comumente encontrado em rochas e conchas e é utilizado na produção de cimento, tintas e suplementos dietéticos.
| Nome IUPAC | Carbonato de cálcio |
| Fórmula molecular | CaCO3 |
| Número CAS | 471-34-1 |
| Sinônimos | Calcário, giz, calcita, aragonita, mármore, carbonato de cálcio precipitado, sal de cálcio de ácido carbônico (1:1) |
| InChI | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Massa molar CaCO3
A massa molar do carbonato de cálcio é 100,09 g/mol. Isto significa que um mol de carbonato de cálcio contém 100,09 gramas do composto. A massa molar é importante nos cálculos estequiométricos porque permite a conversão de moles em gramas ou vice-versa.
Fórmula de Carbonato de Cálcio
A fórmula química do carbonato de cálcio é CaCO₃. Isto significa que cada molécula de carbonato de cálcio contém um átomo de cálcio, um átomo de carbono e três átomos de oxigênio. A fórmula é importante para determinar a quantidade de carbonato de cálcio necessária para uma aplicação específica e para compreender suas propriedades químicas.
Ponto de ebulição do carbonato de cálcio
O carbonato de cálcio não tem ponto de ebulição porque se decompõe antes de atingir o ponto de ebulição. À pressão atmosférica, o carbonato de cálcio decompõe-se em óxido de cálcio e dióxido de carbono a temperaturas acima de 825°C. Portanto, o carbonato de cálcio é comumente usado em aplicações de alta temperatura, como na produção de cimento.
Ponto de fusão do carbonato de cálcio
O ponto de fusão do carbonato de cálcio é 1339°C. A esta temperatura, o carbonato de cálcio sofre decomposição térmica para formar óxido de cálcio e dióxido de carbono. O ponto de fusão é importante para a compreensão do comportamento do carbonato de cálcio em altas temperaturas.
Densidade de Carbonato de Cálcio g/ml
A densidade do carbonato de cálcio é 2,71 g/cm³. Isto significa que o carbonato de cálcio é mais denso que a água e afundará quando colocado na água. A densidade é importante para a compreensão das propriedades físicas do carbonato de cálcio e para determinar seus usos em diversas aplicações.
Peso molecular do carbonato de cálcio
O peso molecular do carbonato de cálcio é 100,09 g/mol. Isso significa que o composto é composto por um átomo de cálcio, um átomo de carbono e três átomos de oxigênio. O peso molecular é importante para determinar a quantidade de carbonato de cálcio necessária para uma aplicação específica e para compreender as suas propriedades químicas.
Estrutura do carbonato de cálcio
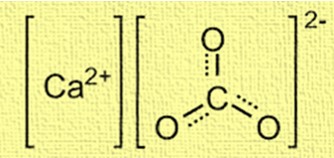
A estrutura do carbonato de cálcio é cristalina e composta por íons cálcio (Ca²⁺) e íons carbonato (CO₃²⁻). Os íons cálcio estão localizados no centro da estrutura e são cercados por seis íons carbonato. Os íons carbonato estão dispostos em forma trigonal planar, com cada átomo de oxigênio conectado ao átomo de carbono por uma ligação dupla. A estrutura é importante para a compreensão do comportamento do carbonato de cálcio em diversas aplicações, como na formação de conchas e recifes de coral.
| Aparência | Pó branco ou cristal incolor |
| Gravidade Específica | 2,71 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 100,09 g/mol |
| Densidade | 2,71g/cm³ |
| Ponto de fusão | 1339ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,0013 g/100 ml (25°C) |
| Solubilidade | Insolúvel em água e na maioria dos solventes orgânicos |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 9h00 (primeiro); 11,8 (segundo) |
| pH | 9,3 – 9,7 (solução aquosa 0,1 M) |
Segurança e perigos do carbonato de cálcio
O carbonato de cálcio é geralmente considerado seguro para os seres humanos e para o meio ambiente quando usado conforme as instruções. Contudo, a inalação de pó de carbonato de cálcio pode causar irritação no trato respiratório, olhos e pele. A exposição prolongada a altas concentrações de pó de carbonato de cálcio pode causar danos aos pulmões. O carbonato de cálcio também pode reagir com ácidos fortes para produzir dióxido de carbono, o que pode causar risco de incêndio ou explosão em determinadas situações. É importante seguir os procedimentos de segurança adequados ao manusear o carbonato de cálcio, como usar equipamento de proteção e garantir ventilação adequada.
| Símbolos de perigo | Não aplicável |
| Descrição de segurança | Evite a inalação de poeira. Use equipamento de proteção. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2836.50.00 |
| Classe de perigo | Não regulamentado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade para humanos e meio ambiente |
Métodos de síntese de carbonato de cálcio
Vários métodos podem sintetizar carbonato de cálcio (CaCo3), incluindo métodos de precipitação, carbonatação e sol-gel.
O método de precipitação envolve a mistura de hidróxido de cálcio com um sal carbonato solúvel, tal como carbonato de sódio , sob condições controladas para formar um precipitado de CaCo3. Para obter o produto final, o precipitado deve ser filtrado e seco.
O método de carbonatação envolve a reação do óxido de cálcio com dióxido de carbono sob alta pressão e temperatura para produzir CaCo3. A reação deve ser realizada em sistema fechado para evitar o escape de dióxido de carbono. Em seguida, qualquer óxido de cálcio ou dióxido de carbono que não tenha reagido deve ser separado do CaCo3 resultante e purificado.
O método sol-gel envolve a hidrólise e condensação de um precursor contendo cálcio, tal como alcóxido de cálcio ou nitrato de cálcio, na presença de um solvente e um catalisador. Para produzir CaCo3, o gel obtido deve ser seco e calcinado.
O método de síntese de CaCo3 envolve o uso de biomineralização, onde organismos vivos como corais ou conchas de ostras geram cristais de CaCo3. Os operadores coletam esses cristais e os processam para obter o produto final.
Cada método tem suas próprias vantagens e desvantagens, e a escolha do método depende de fatores como custo, pureza e tamanho de partícula desejado do produto final.
Usos do carbonato de cálcio
O carbonato de cálcio tem diversos usos em diversas indústrias, devido às suas propriedades como baixa toxicidade, alta pureza e baixo custo de disponibilidade. Alguns usos comuns do carbonato de cálcio são:
- Construção: Utilizado como material de construção na forma de calcário, mármore e giz. Utilizado como enchimento para melhorar a resistência e durabilidade de cimento, argamassa e concreto.
- Produtos farmacêuticos: utilizados na produção de antiácidos e suplementos de cálcio. Utilizado como excipiente na formulação de comprimidos e cápsulas.
- Alimentos e Bebidas: Usado como aditivo alimentar para fortalecer o cálcio e como ajustador de pH em bebidas.
- Papel e celulose: Utilizado como carga e agente de revestimento na produção de papel e cartão, para melhorar a capacidade de impressão e a brancura.
- Plásticos: Utilizados como enchimento e reforço em produtos plásticos, para melhorar suas propriedades mecânicas e reduzir custos.
- Tintas e Revestimentos: Utilizados como pigmento e enchimento em tintas e revestimentos, para melhorar sua opacidade e cobertura.
- Agricultura: Usado como corretivo do solo para melhorar a qualidade do solo e o crescimento das culturas.
- Tratamento de Água: Usado para neutralizar água ácida e remover impurezas da água.
Esses são alguns dos usos mais comuns do carbonato de cálcio, mas existem muitas outras aplicações em diversos setores.
Questões:
P: O carbonato de cálcio é solúvel em água?
R: O carbonato de cálcio possui baixa solubilidade em água, com solubilidade de aproximadamente 0,0013 g/100 mL a 25°C.
P: O que é carbonato de cálcio?
R: O carbonato de cálcio é um composto químico com a fórmula CaCO3. É uma substância comum encontrada em rochas, conchas de organismos marinhos e em diversos depósitos minerais.
P: Onde você pode encontrar carbonato de cálcio?
R: O carbonato de cálcio pode ser encontrado em várias fontes naturais, como calcário, giz e mármore. Também é encontrado nas conchas de organismos marinhos, como ostras, mariscos e corais.
P: O carbonato de cálcio é iônico ou covalente?
R: O carbonato de cálcio é um composto iônico composto por um cátion cálcio (Ca2+) e um ânion carbonato (CO32-).
P: O carbonato de cálcio é um tipo de sedimento hidrogenado que pode ser enterrado e endurecido em _____.
R: O carbonato de cálcio é um tipo de sedimento hidrogenado que pode ser enterrado e endurecido em calcário.
P: As estruturas em camadas feitas de carbonato de cálcio pelas cianobactérias pré-cambrianas são chamadas _____.
R: As estruturas em camadas feitas de carbonato de cálcio pelas cianobactérias pré-cambrianas são chamadas de estromatólitos.
