Carbonato de amônio ((NH4)2CO3) é um sal. É formado quando a amônia e o dióxido de carbono reagem. Tem muitos usos, como assar e cheirar sal.
| Nome da IUPAC | Carbonato de amônio |
| Fórmula molecular | (NH4)2CO3 |
| Número CAS | 506-87-6 |
| Sinônimos | amônia de padeiro, sal volátil, sal Hartshorn, E503 |
| InChI | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Propriedades do carbonato de amônio
Fórmula de Carbonato de Amônio
A fórmula química ou fórmula molecular do carbonato de amônio é (NH4)2CO3 1 . É um sal composto por dois íons amônio e um íon carbonato. Pode ser escrito NH4+ + NH4+ + CO3 2- para mostrar as cargas dos íons.
Massa molar de carbonato de amônio
A massa molar de (NH4)2CO3 é 96,09 g/mol 2 . Para calcular a massa molar, precisamos somar as massas atômicas de todos os átomos da fórmula. As massas atômicas são:
- Nitrogênio: 14,01 g/mol
- Hidrogênio: 1,01 g/mol
- Carbono: 12,01 g/mol
- Oxigênio: 16,00 g/mol
Assim, a massa molar do carbonato de amônio é:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Ponto de ebulição do carbonato de amônio
(NH4)2CO3 não tem ponto de ebulição porque se decompõe antes de atingir essa temperatura. Quando aquecido, decompõe-se em amônia e dióxido de carbono, que escapa do sólido. A reação de decomposição é:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
A temperatura de decomposição depende da umidade e pressão do ambiente, mas geralmente fica em torno de 60°C.
Carbonato de amônio Ponto de fusão
(NH4)2CO3 tem um ponto de fusão de 58°C (136°F; 331 K). No entanto, também se decompõe a esta temperatura e, portanto, não forma uma fase líquida. Em vez disso, ele sublima diretamente do sólido para o gasoso.
Densidade de Carbonato de Amônio g/ml
A densidade de (NH4)2CO3 é 1,50 g/ml. Densidade é a massa por unidade de volume de uma substância. Para calcular a densidade, divida a massa pelo volume. Por exemplo, se tivermos 10 g de (NH4)2CO3 e ele ocupar 6,67 ml de espaço, então a densidade será:
10g/6,67ml = 1,50g/ml
Peso molecular do carbonato de amônio
O peso molecular de (NH4)2CO3 é igual à sua massa molar, que é 96,09 g/mol. Peso molecular e massa molar são frequentemente usados de forma intercambiável, mas têm significados ligeiramente diferentes. O peso molecular é a massa de uma molécula de uma substância, enquanto a massa molar é a massa de um mol (6,022 x 10 ^ 23 moléculas) de uma substância.
Estrutura do carbonato de amônio
A estrutura de (NH4)2CO3 pode ser representada por uma estrutura de pontos de Lewis ou por um modelo de bola e bastão. Uma estrutura de pontos de Lewis mostra os elétrons de valência de cada átomo e como eles são compartilhados ou transferidos para formar ligações. Um modelo de bola e bastão mostra a forma e a disposição dos átomos e das ligações em três dimensões.
Aqui está uma possível estrutura de pontos de Lewis para carbonato de amônio:
OOOO
|| || ||
HNH HNH HCH
| | |
HHH
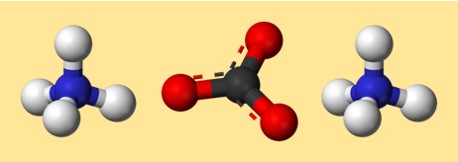
Aqui está um modelo possível para carbonato de amônio:
Neste modelo, cada cor representa um elemento diferente:
- Cinza: carbono
- Vermelho: oxigênio
- Azul: nitrogênio
- Branco: hidrogênio
Solubilidade do carbonato de amônio
(NH4)2CO3 é solúvel em água. Solubilidade é a capacidade de uma substância se dissolver em outra substância. Quando (NH4)2CO3 se dissolve em água, forma íons aquosos que podem interagir com outros íons ou moléculas em solução. A reação de dissolução é:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
A solubilidade do (NH4)2CO3 depende da temperatura e do pH da água. Em temperaturas mais altas, mais (NH4)2CO3 pode se dissolver na água.
| Aparência | pó branco |
| Densidade específica | 1,50 |
| Cor | Incolor |
| Cheiro | Cheiro pungente de amônia |
| Massa molar | 96,09 g/mol |
| Densidade | 1,50g/ml |
| Ponto de fusão | 58°C (136°F; 331K) |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 100g/100ml (15ºC) |
| Solubilidade | Solúvel em água, álcool e acetona |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | 9,25 (para NH4+) |
| pH | 7,8 (para uma solução de 0,1 M) |
Segurança e perigos do carbonato de amônio
(NH4)2CO3 é uma substância perigosa que pode causar irritação e danos à pele, olhos, nariz, garganta e pulmões. Também pode ser prejudicial se ingerido. Deve ser manuseado com cuidado e com equipamentos de proteção individual, como luvas, óculos e máscaras. Deve ser armazenado em local fresco, seco e bem ventilado, longe do calor, faíscas e chamas. Não deve ser misturado com ácidos, bases ou agentes redutores fortes, pois pode reagir violentamente ou libertar gases tóxicos. Se exposto, procure atendimento médico imediatamente.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | S22: Não respirar as poeiras. S24/25: Evitar contato com a pele e os olhos. |
| Números de identificação da ONU | UN3077 |
| Código SH | 28369910 |
| Classe de perigo | 9 |
| Grupo de embalagem | III |
| Toxicidade | Rato LD50 oral: 2.000 mg/kg |
Métodos de síntese de carbonato de amônio
Diferentes métodos podem sintetizar (NH4)2CO3, dependendo dos materiais com os quais eles começam e da pureza desejada do produto. Aqui estão alguns exemplos de métodos para sintetizar (NH4)2CO3:
- Um método envolve a reação de sulfato de amônio com cloreto de amônio e carbonato de cálcio em um forno. A reação produz (NH4)2CO3 e cloreto de cálcio como subprodutos. A reação é:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Outro método envolve reagir com dióxido de carbono e amônia em solução aquosa. A reação produz (NH4)2CO3 e água como subprodutos. A reação é:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Um terceiro método envolve a exposição de uma solução de amônio ao ar contendo dióxido de carbono. O bicarbonato de amônio é o produto da reação e o aquecimento pode decompô-lo ainda mais em (NH4)2CO3.
As reações são:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- A exposição do bicarbonato de amônio ao ar produz (NH4)2CO3 para uso comercial. O bicarbonato de amônio se decompõe em amônia e dióxido de carbono, que reagem novamente para formar (NH4)2CO3. O processo é:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Usos do carbonato de amônio
(NH4)2CO3 tem vários usos em diferentes campos, tais como:
- Os padeiros usam-no como agente de saída, especialmente para biscoitos e bolachas planas ou crocantes. Produz gases dióxido de carbono e amônia que ajudam a massa a crescer e a criar uma textura leve. Também realça o sabor e o aroma dos produtos assados.
- As pessoas o usam como sal cheiroso para reanimar pessoas que desmaiaram ou estão se sentindo infelizes. Estimula o sistema respiratório e aumenta a pressão arterial ao liberar vapores de amônia que irritam o nariz e os pulmões.
- Alguns xaropes para tosse e expectorantes, como o xarope para tosse de Buckley, usam-no como ingrediente ativo. Ajuda a soltar e expelir o catarro do peito e da garganta, aumentando a secreção de muco.
- Os médicos o utilizam como emético para induzir o vômito em casos de envenenamento ou overdose. Irrita a mucosa do estômago e causa náuseas e vômitos ao liberar dióxido de carbono.
- Os químicos o utilizam como reagente em algumas reações químicas, como a síntese de uréia, nitrato de amônio e sulfato de amônio. Também atua como um tampão para manter o pH das soluções.
Questões:
P: O carbonato de amônio é ácido ou básico?
R: (NH4)2CO3 é um sal que pode reagir tanto com ácidos quanto com bases. Quando se dissolve em água, forma íons de amônio e íons de carbonato. Os íons amônio podem atuar como ácidos fracos e doar prótons à água, enquanto os íons carbonato podem atuar como bases fracas e aceitar prótons da água. O pH da solução depende das forças relativas dos íons amônio e dos íons carbonato. Se os íons carbonato forem bases mais fortes do que os íons amônio forem ácidos, a solução será básica. A solução será ácida se os íons amônio forem ácidos mais fortes do que os íons carbonato forem bases. Se os íons amônio e os íons carbonato tiverem forças semelhantes, a solução será neutra.
P: O carbonato de amônio é um sal?
R: Sim, (NH4)2CO3 é um sal. Um sal é um composto que se forma quando um ácido e uma base se neutralizam. (NH4)2CO3 pode se formar quando a amônia, uma base fraca, reage com o ácido carbônico, um ácido fraco. A reação é:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Amônia e ácido carbônico são a base e o ácido originais de (NH4)2CO3.
P: O carbonato de amônio (aq) tem odor na forma aquosa?
R: Sim, (NH4)2CO3 (aq) tem odor na forma aquosa. O odor é devido à liberação de gás amônia da solução. O gás amônia tem um odor pungente que pode irritar o nariz e os pulmões. O gás amônia pode escapar da solução porque é volátil e tem baixa solubilidade em água. A quantidade de gás amônia liberada depende da temperatura e da concentração da solução.
P: Que tipo de átomo é o carbonato de amônio?
R: (NH4)2CO3 não é um átomo, mas uma molécula. Uma molécula é um grupo de átomos ligados entre si pelo compartilhamento de elétrons. Um átomo é a menor unidade de matéria com uma identidade química definida. (NH4)2CO3 é uma molécula composta por quatro tipos diferentes de átomos: nitrogênio, hidrogênio, carbono e oxigênio. A fórmula molecular de (NH4)2CO3 é (NH4)2CO3.
P: Quantos mols existem no carbonato de amônio?
R: Para responder a esta pergunta, precisamos de saber quanto (NH4)2CO3 temos em termos de massa ou volume. Um mol é uma unidade de medida que representa 6,022 x 10 ^ 23 partículas de uma substância. O número de moles de uma substância pode ser calculado dividindo a sua massa pela sua massa molar ou multiplicando o seu volume pela sua molaridade. A massa molar de (NH4)2CO3 é 96,09 g/mol. A molaridade do (NH4)2CO3 depende da sua dissolução em água.
Por exemplo, se tivermos 10 g de (NH4)2CO3, podemos encontrar o número de moles dividindo 10 g por 96,09 g/mol:
10 g / 96,09 g/mol = 0,104 moles
Se tivermos 100 ml de solução 0,1 M (NH4)2CO3, podemos encontrar o número de moles multiplicando 100 ml por 0,1 mol/L:
100 ml x 0,1 mol/L = 0,01 mol
P: Qual é a fórmula química do carbonato de amônio?
R: A fórmula química do carbonato de amônio é (NH4)2CO3. Esta fórmula mostra que uma molécula de (NH4)2CO3 contém dois íons amônio (NH4+) e um íon carbonato (CO3 2-). As cargas dos íons se equilibram, então a carga geral da molécula é zero.
P: Quantos moles de íons de amônio existem em 6,995 g de carbonato de amônio?
R: Para responder a esta pergunta, precisamos seguir duas etapas:
- Primeiro, precisamos determinar quantos moles de (NH4)2CO3 existem em 6,995 g dividindo 6,995 g pela sua massa molar (96,09 g/mol):
6,995 g / 96,09 g/mol = 0,0728 moles
- Segundo, precisamos multiplicar esse número por dois, porque cada mol de (NH4)2CO3 contém dois moles de íons amônio:
0,0728 moles x 2 = 0,1456 moles
Existem, portanto, 0,1456 moles de íons amônio em 6,995 g de (NH4)2CO3.
P: Que gás é produzido quando o ácido clorídrico reage com o carbonato de amônio?
R: Quando o ácido clorídrico reage com (NH4)2CO3, eles sofrem uma reação de duplo deslocamento para produzir cloreto de amônio e ácido carbônico. O ácido carbônico então se decompõe em água e dióxido de carbono. O dióxido de carbono é o gás produzido por esta reação. A equação geral para esta reação é a seguinte:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
A equação iônica líquida para esta reação é:
CO3 2- + 2 H+ -> H2O + CO2
