Butano (C₄H₁₀) é um gás hidrocarboneto altamente inflamável. É comumente usado como combustível para isqueiros e fogões de acampamento devido às suas propriedades de queima eficiente e portabilidade.
| Nome IUPAC | Butano |
| Fórmula molecular | C₄H₁₀ |
| Número CAS | 106-97-8 |
| Sinônimos | n-Butano, hidreto de butila, metiletilmetano, dietil |
| InChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2.1-2H3 |
Propriedades do butano
Fórmula de butano
A fórmula do butano é C₄H₁₀, o que indica que ele é composto por quatro átomos de carbono e dez átomos de hidrogênio. A fórmula fornece informações valiosas sobre a composição química do butano, permitindo aos cientistas estudar suas propriedades e comportamento.
Massa molar de butano
A massa molar do hidreto de butila pode ser calculada somando as massas atômicas de seus elementos constituintes. Para hidreto de butila (C₄H₁₀), a massa molar é de aproximadamente 58,12 gramas por mol. A massa molar é um parâmetro crucial em vários cálculos químicos e desempenha um papel importante na determinação das propriedades físicas e químicas do hidreto de butila.
Ponto de ebulição do butano
O hidreto de butila tem um ponto de ebulição relativamente baixo, em torno de -1°C (30°F). Isso significa que nessa temperatura ou acima, o hidreto de butila transita facilmente de uma fase líquida para uma fase gasosa. O baixo ponto de ebulição torna o hidreto de butila um combustível ideal para aplicações como isqueiros e fogões de acampamento portáteis.
Ponto de fusão do butano
O ponto de fusão do hidreto de butila é de aproximadamente -138,4°C (-217,12°F). Nessa temperatura ou abaixo dela, o hidreto de butila sólido sofre uma mudança de fase e se torna líquido. No entanto, sob condições atmosféricas normais, o hidreto de butila é comumente encontrado na sua forma gasosa.
Densidade de butano g/mL
A densidade do hidreto de butila é de aproximadamente 2,48 gramas por mililitro. Isso indica que o hidreto de butila é mais leve que a água, que tem densidade de 1 g/mL. A densidade do hidreto de butila é uma propriedade crucial que determina seu comportamento durante o armazenamento ou transporte, bem como suas características de combustão.
Peso molecular do butano
O peso molecular do hidreto de butila é de aproximadamente 58,12 gramas por mol. Representa a soma dos pesos atômicos de todos os átomos em uma única molécula de hidreto de butila. O peso molecular é um parâmetro essencial para diversos cálculos científicos e ajuda a compreender as propriedades e o comportamento do hidreto de butila.
Estrutura do butano
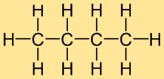
A estrutura do hidreto de butila consiste em uma cadeia linear de quatro átomos de carbono, aos quais estão ligados dez átomos de hidrogênio. Os átomos de carbono estão dispostos em uma linha contínua e cada átomo de carbono forma ligações simples com dois átomos de carbono vizinhos e três átomos de hidrogênio. Esta estrutura linear contribui para as propriedades físicas e químicas do hidreto de butila.
Solubilidade do butano
O hidreto de butila é considerado relativamente insolúvel em água. Apresenta baixa solubilidade devido à sua natureza apolar e fracas interações intermoleculares com moléculas de água. No entanto, o hidreto de butila é altamente solúvel em solventes orgânicos como etanol e acetona. Este comportamento de solubilidade é importante em diversas aplicações, como processos de extração e reações à base de solvente.
| Aparência | Gás incolor |
| Gravidade Específica | 2,48 |
| Cor | N / D |
| Cheiro | Inodoro |
| Massa molar | 58,12 g/mol |
| Densidade | 2,48g/ml |
| Ponto de fusão | -138,4°C (-217,12°F) |
| Ponto de ebulição | -1°C (30°F) |
| Ponto flash | -60°C (-76°F) |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | 2,4 caixas eletrônicos a 20°C |
| Densidade do vapor | 2,07 (ar = 1) |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do butano
O hidreto de butila apresenta certos riscos de segurança que precisam ser considerados. É um gás altamente inflamável e pode inflamar-se facilmente na presença de uma fonte de ignição. Devem ser tomadas precauções para evitar incêndios ou explosões acidentais. É importante armazenar e manusear o hidreto de butila em áreas bem ventiladas para evitar o acúmulo de vapores inflamáveis. A inalação direta de hidreto de butila pode ser prejudicial porque desloca o oxigênio e pode causar asfixia. Além disso, a exposição a altas concentrações de hidreto de butila pode causar tonturas, sonolência e náusea. É essencial seguir as devidas precauções de segurança, como usar hidreto de butila em equipamentos devidamente projetados e aprovados e evitar contato com chamas abertas ou faíscas.
| Símbolos de perigo | Gás inflamável |
| Descrição de segurança | Mantenha longe de chamas e faíscas. Armazene em uma área bem ventilada. Evite inalação e contato direto. |
| Identificadores das Nações Unidas | ONU 1011 |
| Código SH | 2711.12.20 |
| Classe de perigo | Classe 2.1 (Gás inflamável) |
| Grupo de embalagem | Grupo de embalagem II |
| Toxicidade | O hidreto de butila é geralmente considerado de baixa toxicidade. Contudo, a inalação de concentrações elevadas pode causar tonturas, sonolência e náuseas. Também pode deslocar o oxigênio em espaços fechados, levando à asfixia. Procedimentos adequados de ventilação e manuseio devem ser seguidos para garantir a segurança. |
Métodos de síntese de butano
Vários métodos sintetizam hidreto de butila, envolvendo principalmente a produção de petróleo ou gás natural.
Destilação Fracionada: Durante a destilação fracionada de petróleo bruto ou petróleo, o processo produz hidreto de butila como subproduto. O processo de refino separa diferentes frações de hidrocarbonetos com base em seus pontos de ebulição, e o hidreto de butila é um dos componentes que podem ser isolados.
Processamento de gás natural: O processamento de gás natural também produz hidreto de butila. O gás natural contém vários hidrocarbonetos, incluindo metano e hidrocarbonetos superiores, como o hidreto de butila. A mistura de gás natural passa por processos como absorção ou separação criogênica para separar o hidreto de butila.
Craqueamento de hidrocarbonetos: O processo de craqueamento quebra cadeias maiores de hidrocarbonetos em cadeias menores, produzindo hidreto de butila. Isto envolve submeter hidrocarbonetos mais pesados a altas temperaturas ou usar catalisadores para gerar hidreto de butila como produto.
Isomerização: A isomerização reorganiza a estrutura molecular dos hidrocarbonetos, permitindo a síntese do hidreto de butila isomerizando outros hidrocarbonetos como pentano ou hexano em seus isômeros. Catalisadores específicos catalisam este processo sob condições apropriadas.
Processo de Síntese: No laboratório, os cientistas podem sintetizar hidreto de butila por meio de rotas sintéticas. Eles podem usar várias reações químicas, como hidrogenação ou redução, para produzir hidreto de butila a partir de compostos precursores.
Esses métodos possibilitam a produção de hidreto de butila em processos industriais de grande escala, bem como em laboratórios de menor escala. A escolha do método depende da disponibilidade da matéria-prima, da pureza desejada e dos requisitos específicos da aplicação.
Usos do butano
O hidreto de butila encontra aplicação em diversas indústrias e no uso diário devido às suas propriedades benéficas. Aqui estão alguns usos comuns do hidreto de butila:
- Combustível: O hidreto de butila alimenta fogões portáteis, aquecedores de acampamento e isqueiros como combustível, graças ao seu alto conteúdo energético e propriedades de queima eficientes.
- Propelente de aerossol: O hidreto de butila impulsiona produtos em aerossol, como sprays de cabelo, purificadores de ar e tintas em aerossol, permitindo que sejam liberados como uma névoa fina ou spray.
- Refrigerante: O hidreto de butila resfria e mantém baixas temperaturas em sistemas de refrigeração de pequena escala, como refrigeradores e freezers domésticos, servindo como refrigerante.
- Fluido de isqueiro: O hidreto de butila alimenta isqueiros e isqueiros, gerando uma chama que é um componente-chave dos fluidos de isqueiro.
- Extração: O hidreto de butila atua como solvente na extração de óleos essenciais e compostos vegetais de materiais botânicos, dissolvendo efetivamente os compostos desejados.
- Uso em laboratório: Os laboratórios usam hidreto de butila como combustível para queimadores de Bunsen e cromatografia gasosa.
- Gás de calibração: O hidreto de butila serve como gás de calibração para detectores e sensores de gás, fornecendo propriedades bem definidas e facilmente mensuráveis.
- Soldagem e brasagem: As tochas de hidreto de butila facilitam as operações de soldagem e brasagem graças às suas altas temperaturas, precisão e facilidade de uso.
- Recreação: O hidreto de butila alimenta fogões de acampamento portáteis e lanternas, melhorando as atividades recreativas ao ar livre, como acampar, fazer caminhadas e cozinhar.
- Fonte de consumo: O hidreto de butila serve como fonte de calor em uma variedade de aplicações, incluindo ferramentas de aquecimento, pequenos aquecedores e aplicações à base de chama em indústrias específicas.
A natureza versátil do hidreto de butila e sua gama de aplicações tornam-no um composto valioso em diversas indústrias, utensílios domésticos e atividades recreativas.
Pergunta:
P: Onde posso comprar gás butano perto de mim?
R: Geralmente você pode encontrar gás hidreto de butila em lojas de ferragens locais, supermercados ou lojas de conveniência que vendem suprimentos para camping.
P: O gás butano é gás natural?
R: Não, o hidreto de butila não é considerado gás natural. É um gás hidrocarboneto derivado do processamento de petróleo ou gás natural.
P: O que é butano?
R: O hidreto de butila é um hidrocarboneto gasoso com a fórmula química C₄H₁₀. É um gás inflamável incolor e inodoro comumente utilizado como combustível e em diversas aplicações.
P: Como é feito o butano?
R: O hidreto de butila é fabricado principalmente por processos como destilação fracionada de petróleo ou gás natural, craqueamento de hidrocarbonetos mais pesados ou isomerização de outros hidrocarbonetos.
P: Como recarregar um isqueiro de butano?
R: Para encher um isqueiro de hidreto de butila, primeiro localize a válvula de recarga, geralmente na parte inferior. Insira o bico de hidreto de butila na válvula e pressione firmemente para liberar o hidreto de butila no lúmen até que esteja cheio.
P: Qual dos seguintes compostos é um isômero estrutural do butano?
R: Pentano (C₅H₁₂) é um isômero estrutural do hidreto de butila, pois ambos os compostos contêm quatro átomos de carbono, mas têm arranjos diferentes.
P: Como recarregar um isqueiro de butano?
R: Para recarregar um isqueiro de hidreto de butila, segure o isqueiro de cabeça para baixo, alinhe o bico do cartucho de recarga de hidreto de butila com a válvula de recarga do isqueiro e pressione firmemente o cartucho para liberar o hidreto do butil no isqueiro.
P: Onde posso comprar butano perto de mim?
R: Você pode comprar hidreto de butila em lojas de ferragens locais, supermercados ou lojas de conveniência que estocam materiais de acampamento ou utensílios domésticos.
P: Onde comprar butano?
R: O hidreto de butila pode ser adquirido em uma variedade de fontes, incluindo varejistas on-line, lojas de ferragens, lojas de materiais para camping e alguns supermercados.
P: Qual afirmação compara melhor o ponto de fusão do butano (C₄H₁₀) com o do octano (C₈H₁₈)?
R: O octano, com uma estrutura molecular maior e mais complexa, geralmente tem um ponto de fusão mais alto que o hidreto de butila.
P: Qual é a massa molar do butano, C₄H₁₀?
R: A massa molar do hidreto de butila (C₄H₁₀) é de aproximadamente 58,12 gramas por mol.
P: Quantos isômeros são possíveis para C₄H₁₀?
R: O hidreto de butila (C₄H₁₀) tem dois isômeros: n-butano (butano normal) e isobutano (2-metilpropano).
P: Qual dos compostos C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ deveria existir como moléculas?
R: Espera-se que C₄H₁₀ (hidreto de butila) e OF₂ (difluoreto de oxigênio) existam como moléculas, enquanto SrCl₂ e Cr(NO₃)₃ são compostos iônicos.
