O borohidreto de sódio (NaBH4) é um pó cristalino branco usado como agente redutor em síntese orgânica e como fonte de hidrogênio para células de combustível. É muito reativo e sensível à água.
| Nome IUPAC | Tetrahidroborato de sódio |
| Fórmula molecular | NaBH4 |
| Número CAS | 16940-66-2 |
| Sinônimos | Borohidreto de sódio, tetrahidridoborato de sódio, borohidreto de sódio hidratado, tetrahidroborato hidratado de sódio |
| InChI | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
Propriedades do borohidreto de sódio
Ponto de ebulição do borohidreto de sódio
O borohidreto de sódio não tem ponto de ebulição bem definido porque se decompõe quando aquecido. A temperatura de decomposição depende das condições de temperatura e pressão.
Ponto de fusão do borohidreto de sódio
O borohidreto de sódio tem um ponto de fusão de 240 a 242°C. A esta temperatura, a forma sólida do NaBH4 muda para o estado líquido.
Densidade de borohidreto de sódio g/ml
A densidade do borohidreto de sódio é 1,33 g/ml. É um sólido cristalino branco relativamente denso em comparação com outras substâncias.
Massa molar de Borohidreto de Sódio
A massa molar do Borohidreto de Sódio (NaBH4) é 37,83 g/mol. É calculado somando as massas atômicas de todos os átomos presentes na fórmula molecular do NaBH4 (1 átomo de sódio, 1 átomo de boro e 4 átomos de hidrogênio).
Peso molecular de borohidreto de sódio
O peso molecular do borohidreto de sódio é 37,83 g/mol. Esta é a soma das massas atômicas dos átomos individuais na fórmula molecular do NaBH4.
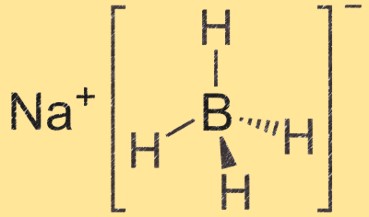
Estrutura do borohidreto de sódio
O borohidreto de sódio é uma molécula tetraédrica com um íon sódio no centro e quatro grupos hidreto de boro ligados a ele. O átomo de boro está ligado a quatro átomos de hidrogênio, criando uma estrutura tetraédrica.
Fórmula de Boroidreto de Sódio
A fórmula química do tetrahidroborato de sódio é NaBH4. É composto por um átomo de sódio (Na), um átomo de boro (B) e quatro átomos de hidrogênio (H). Esta fórmula representa a composição química desta substância e sua composição elementar.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 1,33g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 37,83 g/mol |
| Densidade | 1,33g/ml |
| Ponto de fusão | 240-242°C |
| Ponto de ebulição | Decompõe-se no aquecimento |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do borohidreto de sódio
O tetrahidroborato de sódio é inflamável e reativo com água. Pode liberar gás hidrogênio inflamável e formar misturas explosivas com o ar. O tetrahidroborato de sódio também é irritante para a pele e os olhos. Ventilação adequada e equipamento de proteção individual devem ser usados para minimizar a exposição ao manusear tetrahidroborato de sódio. Armazene-o em local fresco e seco, longe de fontes de ignição e água.
| Símbolos de perigo | Inflamável, Irritante |
| Descrição de segurança | S26, S36/37 |
| Números de identificação da ONU | UN3375 |
| Código SH | 2827.90.90 |
| Classe de perigo | 4.3 |
| Grupo de embalagem | II |
| Toxicidade | Moderadamente tóxico por ingestão, inalação e contato com a pele |
Métodos para a síntese de borohidreto de sódio
O borohidreto de sódio (NaBH4) pode ser sintetizado por vários métodos, incluindo:
- Redução do sódio metálico: Este método envolve a redução do trióxido de boro (B2O3) com sódio metálico para produzir NaBH4.
- Redução de hidreto de sódio: Hidreto de sódio (NaH) pode ser usado para reduzir trihaletos de boro para produzir NaBH4.
- Redução de hidreto de alumínio e lítio: O hidreto de alumínio e lítio (LiAlH4) pode ser usado para reduzir haletos de boro para produzir NaBH4.
- Hidrogenação: O borohidreto de sódio pode ser sintetizado pela hidrogenação do borohidreto de sódio (NaBH3H).
Equipamento especializado e pessoal treinado em um ambiente bem ventilado devem realizar todos esses métodos porque o tetrahidroborato de sódio é inflamável e reativo. O método de síntese selecionado dependerá do rendimento desejado, pureza e considerações de custo.
Usos do borohidreto de sódio
O tetrahidroborato de sódio (NaBH4) é um agente redutor versátil e possui uma ampla gama de aplicações em diversos campos. Alguns dos usos comuns do tetrahidroborato de sódio são:
- Síntese Orgânica: O NaBH4 é utilizado na redução de compostos carbonílicos, ésteres, nitrilas e amidas aos seus correspondentes álcoois, aldeídos e aminas.
- Produtos farmacêuticos: O tetrahidroborato de sódio é utilizado na síntese de diversos princípios farmacêuticos ativos e na preparação de compostos quirais.
- Ciência de Polímeros: O NaBH4 é utilizado na redução de resinas epóxi e resinas de poliéster insaturadas.
- Meio ambiente: O tetrahidroborato de sódio pode ser usado no tratamento de águas residuais para reduzir poluentes como metais pesados e corantes.
- Indústria alimentícia: O NaBH4 é utilizado como agente redutor na produção de pastas para barrar com baixo teor de gordura, sorvetes e chocolate.
No geral, o tetrahidroborato de sódio provou ser uma ferramenta valiosa no campo da síntese química devido às suas propriedades redutoras suaves e à sua capacidade de reduzir seletivamente grupos funcionais em estruturas moleculares complexas.
Questões:
Qual destes compostos pode ser reduzido pelo borohidreto de sódio? marque todas as opções aplicáveis.
O tetrahidroborato de sódio (NaBH4) pode reduzir uma ampla gama de compostos, incluindo:
- Compostos carbonílicos, como aldeídos e cetonas
- Nitrilos
- Ésteres
- Amidas
- Resinas epóxi
- Resinas de poliéster insaturadas
- Certos corantes
- Metais pesados
- Compostos quirais
É importante notar que condições específicas e parâmetros de reação podem afetar a eficiência da redução e a seletividade do processo de redução. Além disso, nem todos os compostos são adequados para redução com tetrahidroborato de sódio, pois alguns podem sofrer reações colaterais indesejáveis.
Por que é importante expor o borohidreto de sódio à umidade?
A exposição do tetrahidroborato de sódio (NaBH4) à umidade é importante por vários motivos:
- Reatividade: O tetrahidroborato de sódio é muito reativo e pode se decompor rapidamente na presença de umidade, gerando gás hidrogênio e calor. Isso pode representar risco de explosão e incêndio se não for manuseado corretamente.
- Hidrólise: O tetrahidroborato de sódio hidrolisa facilmente na presença de umidade para formar hidrato de tetrahidroborato de sódio (NaBH4.xH2O), que possui propriedades redutoras reduzidas em comparação com a forma anidra.
- Estabilidade de armazenamento: A umidade pode causar a decomposição gradual do tetrahidroborato de sódio, reduzindo sua vida útil e eficácia como agente redutor.
Portanto, é importante armazenar o borohidreto de sódio em um recipiente seco e hermético e manuseá-lo em ambiente bem ventilado para minimizar a exposição à umidade. Se a exposição à umidade for inevitável, o uso de agentes eliminadores de umidade ou atmosferas protetoras pode ajudar a minimizar seus efeitos na estabilidade e na reatividade do tetrahidroborato de sódio.
O borohidreto de sódio é um catalisador?
O tetrahidroborato de sódio (NaBH4) geralmente não é considerado um catalisador, mas sim um agente redutor. Um catalisador é uma substância que acelera uma reação química sem sofrer mudanças permanentes. O tetrahidroborato de sódio muda quimicamente à medida que é reduzido, sendo consumido na reação de redução.
A síntese orgânica e as reações de redução geralmente usam tetrahidroborato de sódio como fonte de íons hidreto (H-). O tetrahidroborato de sódio transfere esses íons hidreto para a molécula do substrato, reduzindo assim grupos funcionais como carbonilas, nitrilas e ésteres. Apesar de seu papel como agente redutor, o tetrahidroborato de sódio pode desempenhar um papel secundário como aceitador de prótons, tornando-o uma base suave que pode influenciar as condições da reação e afetar o resultado da reação.
Que gás inflamável é produzido se o borohidreto de sódio for misturado com água?
Se o tetrahidroborato de sódio (NaBH4) for misturado com água, ele sofre hidrólise rápida para formar borohidreto de sódio hidratado (NaBH4.xH2O) e gás hidrogênio. O gás hidrogênio produzido é inflamável e pode apresentar risco de explosão e incêndio se não for manuseado adequadamente.
A reação entre o tetrahidroborato de sódio e a água pode ser exotérmica e gerar calor, o que pode acelerar ainda mais a taxa de hidrólise e aumentar a liberação de gás hidrogênio. A reação também pode gerar um grande volume de gás em pouco tempo, criando risco de sobrepressão e explosão.
Portanto, é importante manusear o tetrahidroborato de sódio em ambiente bem ventilado e evitar expô-lo à umidade ou água. Se a exposição à umidade for inevitável, o uso de agentes eliminadores de umidade ou atmosferas protetoras pode ajudar a minimizar a taxa de hidrólise e a liberação de gás hidrogênio.
Quantos moles de cânfora reagem com o borohidreto de sódio?
O número de moles de cânfora que reagirão com o tetrahidroborato de sódio (NaBH4) depende de vários fatores, incluindo a estequiometria da reação, a concentração e pureza dos reagentes e as condições da reação. A estequiometria da reação pode ser determinada a partir da equação química para a redução da cânfora a isoborneol usando tetrahidroborato de sódio:
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
De acordo com a equação, um mol de cânfora reage com 4 moles de tetrahidroborato de sódio. A quantidade real de cânfora que reagirá com uma determinada quantidade de NaBH4 dependerá da concentração e pureza dos reagentes, bem como das condições de reação, como temperatura, tempo e catalisador.
Portanto, sem informações mais precisas, não é possível determinar o número exato de moles de cânfora que reagirão com o tetrahidroborato de sódio.
