O bissulfito de cálcio (Ca(HSO3)2) é um composto composto de cálcio, enxofre e oxigênio. É comumente usado como conservante de alimentos e antioxidante na indústria alimentícia.
| Nome IUPAC | Hidrogenossulfito de cálcio |
| Fórmula molecular | Ca(HSO3)2 |
| Número CAS | 13780-03-5 |
| Sinônimos | Bissulfito de cálcio, Hidrogenossulfito de cálcio, Ácido sulfuroso de cálcio, Bissulfito de cal |
| InChI | InChI=1S/Ca.2H2O3S/c;2*1-4(2)3/h;(H2,1,2,3)/q+2;;/p-2 |
Propriedades do bissulfito de cálcio
Fórmula de Bissulfito de Cálcio
A fórmula química do bissulfito de cálcio é Ca(HSO3)2. Indica o número e tipo de átomos em uma molécula ou unidade de fórmula. A fórmula é importante na determinação do peso molecular, massa molar e outras propriedades do composto. Ca(HSO3)2 é um importante composto utilizado na indústria alimentícia como conservante e antioxidante.
Massa molar de bissulfito de cálcio
Ca(HSO3)2 tem massa molar de 202,2 g/mol. É um composto iônico composto de cálcio, sulfito de hidrogênio e dióxido de enxofre. A massa molar é importante para calcular a quantidade de Ca(HSO3)2 necessária em uma reação ou para preparar uma solução com a concentração desejada.
Ponto de ebulição do bissulfito de cálcio
O ponto de ebulição do Ca(HSO3)2 não é um valor bem definido porque se decompõe antes de atingir o seu ponto de ebulição. Ca(HSO3)2 se decompõe liberando dióxido de enxofre. Portanto, não é utilizado em processos que exijam aplicações em altas temperaturas.
Ponto de fusão do bissulfito de cálcio
O ponto de fusão do Ca(HSO3)2 é 203°C. A esta temperatura, decompõe-se formando sulfato de cálcio e dióxido de enxofre. A decomposição do Ca(HSO3)2 é uma reação exotérmica e produz uma grande quantidade de calor. Portanto, deve ser manuseado com cuidado quando aquecido.
Densidade de bissulfito de cálcio g/mL
A densidade do Ca(HSO3)2 varia dependendo da forma em que se encontra. A forma anidra de Ca(HSO3)2 tem densidade de 2,68 g/mL, enquanto a forma di-hidratada tem densidade de 1,98 g/mL. A densidade de uma substância é importante para determinar quanto da substância é necessária para preencher um determinado volume.
Peso molecular do bissulfito de cálcio
O peso molecular do Ca(HSO3)2 é 202,2 g/mol. É calculado somando os pesos atômicos dos elementos constituintes: cálcio (40,08 g/mol), hidrogênio (1,008 g/mol), enxofre (32,06 g/mol) e oxigênio (15,99 g/mol). O peso molecular é importante para determinar a quantidade de substância necessária para uma reação.
Estrutura do bissulfito de cálcio
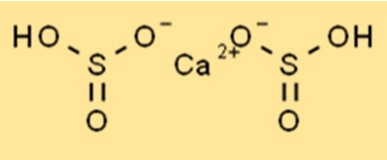
A estrutura do Ca(HSO3)2 é um composto iônico com a fórmula química Ca(HSO3)2. Tem forma tetraédrica com um átomo central de cálcio rodeado por quatro átomos de oxigênio. Os íons sulfito de hidrogênio estão ligados ao átomo de cálcio por ligações iônicas. A estrutura do Ca(HSO3)2 é importante para a compreensão de suas propriedades químicas.
Solubilidade do bissulfito de cálcio
Ca(HSO3)2 é moderadamente solúvel em água, com solubilidade de aproximadamente 60 gramas por 100 mililitros de água à temperatura ambiente. Sua solubilidade aumenta com a temperatura e também é solúvel em etanol e glicerol.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,68 (anidro), 1,98 (dihidrato) |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 202,2 g/mol |
| Densidade | 2,68 g/mL (anidro), 1,98 g/mL (di-hidratado) |
| Ponto de fusão | 203ºC |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, insolúvel em solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 1,92 |
| pH | 4,5-6,0 |
Segurança e perigos do bissulfito de cálcio
O Ca(HSO3)2 é geralmente considerado seguro quando utilizado em pequenas quantidades em produtos alimentares. No entanto, pode ser perigoso se não for manuseado corretamente. Pode causar irritação na pele, irritação nos olhos e problemas respiratórios se inalado. A ingestão de grandes quantidades pode causar distúrbios gastrointestinais, incluindo náuseas e vômitos. O Ca(HSO3)2 deve ser manuseado com cuidado e equipamentos de proteção, como luvas e respirador, devem ser usados ao trabalhar com ele. Deve ser armazenado em local fresco e seco, longe do calor e de materiais incompatíveis. Os derramamentos devem ser limpos imediatamente para evitar exposição à substância.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite inalação, ingestão e contato com a pele/olhos. Use equipamento de proteção. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 28321000 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade, mas pode causar irritação na pele e nos olhos, problemas respiratórios e distúrbios gastrointestinais se ingerido em grandes quantidades. |
Métodos para a síntese de bissulfito de cálcio
Vários métodos podem ser usados para sintetizar Ca(HSO3)2.
Um método envolve a reação do gás dióxido de enxofre com hidróxido de cálcio , produzindo Ca(HSO3)2 e água.
O processo envolve a reação do óxido de cálcio com o gás dióxido de enxofre, gerando sulfito de cálcio. Então, a reação do gás dióxido de enxofre com sulfito de cálcio produz Ca(HSO3)2.
A reação do gás dióxido de enxofre com água e carbonato de cálcio produz Ca(HSO3)2, gás dióxido de carbono e água.
Para sintetizar Ca(HSO3)2 em laboratório, pode-se adicionar gás dióxido de enxofre a uma solução de hidróxido de cálcio ou óxido de cálcio até atingir o pH desejado. A solução resultante conterá Ca(HSO3)2, que pode ser purificado por métodos de filtração ou precipitação.
Usos do bissulfito de cálcio
Ca(HSO3)2 tem diversos usos em diversas indústrias devido às suas propriedades únicas. Aqui estão alguns dos usos mais comuns do Ca(HSO3)2:
- Indústria alimentar: Utilizado como conservante alimentar para prevenir o crescimento de bactérias e outros microrganismos em produtos alimentares, especialmente em frutas e vegetais.
- Tratamento de Água: Usado no tratamento de água para remover o excesso de cloro e outros produtos químicos da água e para prevenir o crescimento de bactérias e algas nos sistemas de água.
- Indústria Têxtil: Utilizado na indústria têxtil para remover o excesso de corante do tecido e evitar o desbotamento durante o processo de tingimento.
- Indústria de papel: Utilizado na indústria de papel para branquear a celulose e prevenir a descoloração dos produtos de papel.
- Indústria química: Utilizado na indústria química como agente redutor e como fonte de gás dióxido de enxofre.
- Indústria farmacêutica: Utilizado na indústria farmacêutica como antioxidante e conservante em determinados medicamentos.
Questões:
P: A Autoridade Europeia para a Segurança dos Alimentos aprova o bissulfito de cálcio?
R: Sim, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) aprovou a utilização de Ca(HSO3)2 como aditivo alimentar. Está listado como conservante alimentar aprovado na União Europeia.
P: Qual é a classificação E do bissulfito de cálcio?
R: O número E de Ca(HSO3)2 é E227. O número E é um código atribuído aos aditivos alimentares pela União Europeia.
P: O bissulfito de cálcio é seguro?
R: Ca(HSO3)2 é geralmente considerado seguro para consumo em pequenas quantidades. No entanto, pode causar irritação na pele e nos olhos, problemas respiratórios e distúrbios gastrointestinais se ingerido em grandes quantidades. É importante manusear e armazenar adequadamente o Ca(HSO3)2 para garantir sua segurança.
P: Qual é a solubilidade do bissulfito de cálcio em água?
R: Ca(HSO3)2 é moderadamente solúvel em água, com solubilidade de aproximadamente 60 gramas por 100 mililitros de água à temperatura ambiente.
P: Quais são as propriedades termodinâmicas do bissulfito de cálcio?
R: As propriedades termodinâmicas do Ca(HSO3)2 incluem um ponto de fusão de aproximadamente 150°C e um ponto de ebulição de aproximadamente 160°C. Sua capacidade térmica e entalpia de formação também foram investigadas em vários estudos de pesquisa.
