O bifluoreto de amônio (NH5F2) é um composto químico. Dissolve-se em água e forma ácido fluorídrico. Pode atacar vidros e corroer metais.
| Nome da IUPAC | Fluoreto de hidrogênio e amônio |
| Fórmula molecular | [NH4] [HF2] |
| Número CAS | 1341-49-7 |
| Sinônimos | Fluoreto de ácido de amônio, hidrofluoreto de amônio, difluoreto de amônio, hidrogenodifluoreto de amônio, hidrogenodifluoreto de amônio |
| InChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Propriedades do bifluoreto de amônio
Fórmula de bifluoreto de amônio
A fórmula do bifluoreto de amônio é [NH4][HF2] ou [NH4]F·HF. Isso indica que o composto contém um cátion de amônio ([NH4]+) e um ânion bifluoreto ou hidrogênio (difluoreto) ([HF2]−). A fórmula também pode ser escrita como NH5F2, que indica o número de átomos de cada elemento do composto.
Massa molar de bifluoreto de amônio
A massa molar do difluoreto de amônio é 57,044 g/mol. É calculado somando as massas atômicas dos elementos na fórmula: (14,007 + 4 × 1,008) + (2 × 18,998) = 57,044 g/mol.
Ponto de ebulição do bifluoreto de amônio
O ponto de ebulição do difluoreto de amônio é 240 °C (464 °F; 513 K). Porém, o composto se decompõe antes de atingir essa temperatura, liberando gases amônia e fluoreto de hidrogênio 1 . Portanto, o difluoreto de amônio não tem ponto de ebulição verdadeiro.
Ponto de fusão do bifluoreto de amônio
O ponto de fusão do difluoreto de amônio é 126 °C (259 °F; 399 K). Esta é a temperatura na qual o composto sólido se transforma em líquido. O ponto de fusão depende da força das forças intermoleculares entre as moléculas do composto.
Densidade de bifluoreto de amônio g/ml
A densidade do difluoreto de amônio é 1,50 g/ml. É a massa do composto por unidade de volume. A densidade pode ser medida dividindo a massa de uma amostra pelo seu volume. A densidade de uma substância depende de sua estrutura molecular e embalagem.
Peso molecular do bifluoreto de amônio
O peso molecular do difluoreto de amônio é 57,044 g/mol. Isso é igual à massa molar do composto. O peso molecular pode ser usado para calcular o número de moles de uma substância em uma determinada massa ou volume.
Estrutura do bifluoreto de amônio
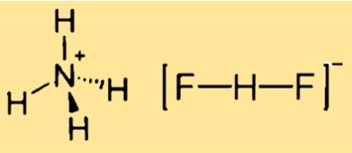
A estrutura do difluoreto de amônio é cúbica, relacionada à estrutura do CsCl. Isso significa que o composto possui uma rede cristalina com uma célula unitária cúbica, onde cada cátion de amônio é cercado por quatro centros de fluoreto em um tetraedro, e cada ânion difluoreto é linear. A estrutura pode ser representada por um modelo tridimensional ou por um diagrama bidimensional.
Solubilidade do bifluoreto de amônio
A solubilidade do difluoreto de amônio em água é de 63 g/100 ml a 20°C. Isto significa que 63 gramas do composto podem dissolver-se em 100 mililitros de água a esta temperatura. A solubilidade depende da polaridade e da capacidade de ligação de hidrogênio do composto e do solvente.
| Aparência | Cristais incolores ou cristal branco |
| Densidade específica | 1,50 |
| Cor | Incolor |
| Cheiro | Ligeiramente picante, picante |
| Massa molar | 57,044 g/mol |
| Densidade | 1,50g/cm3 |
| Ponto de fusão | 126°C (259°F; 399K) |
| Ponto de ebulição | 240 °C (464 °F; 513 K) (decompõe-se) |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 63g/100ml (20ºC) |
| Solubilidade | Ligeiramente solúvel em álcool, insolúvel em amônia líquida |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não disponível |
Segurança e perigos do bifluoreto de amônio
O difluoreto de amônio é um produto químico tóxico e corrosivo que pode prejudicá-lo se você engolir, respirar ou tocar. Pode causar queimaduras graves e lesões oculares, hemorragias nasais, tosse, respiração ofegante, falta de ar, náuseas, vómitos e perda de apetite. Também pode liberar fluoreto de hidrogênio quando aquecido, o que é muito perigoso de inalar. Você deve evitar o contato com este produto químico e usar luvas de proteção, roupas e proteção para os olhos e rosto ao manuseá-lo. Se você estiver exposto, lave imediatamente com água e procure atendimento médico. Você também deve lavar qualquer roupa contaminada antes de usá-la novamente.
| Símbolos de perigo | T, C |
| Descrição de segurança | S26, S36/37/39, S45 |
| Números de identificação da ONU | ONU 1727 (sólido), ONU 2817 (solução) |
| Código SH | 2826.19 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | LD50 oral (rato) = 200 mg/kg |
Métodos para a síntese de bifluoreto de amônio
Diferentes métodos são usados para preparar difluoreto de amônio, um sal inorgânico. Alguns dos métodos comuns são:
- Processo de fase de vapor: Este método envolve a reação do gás amônia e do gás fluoreto de hidrogênio em altas temperaturas e pressão. O produto é um pó de difluoreto de amônio seco e puro. Porém, este método requer equipamentos complexos e altos investimentos.
- Método de fase líquida: Este método envolve a reação de soluções aquosas de amônia e fluoreto de hidrogênio ou fluoreto de amônio e ácido fluorídrico a temperatura e pressão moderadas. O produto é um cristal de difluoreto de amônio úmido e menos puro. As pessoas usam esse método amplamente porque é simples, mas o produto é de baixa qualidade e tende a absorver umidade e bolo.
- Método de neutralização: Este método envolve a reação de uma solução insaturada de fluoreto de amônio e ácido fluorídrico , seguida da adição de solução de amônia para neutralizar o excesso de ácido fluorídrico. O produto é um cristal de difluoreto de amônio relativamente puro e estável. Este método pode melhorar a qualidade do produto e reduzir a poluição ambiental.
Usos do bifluoreto de amônio
O difluoreto de amônio é um sal inorgânico que possui diversos usos em diversas indústrias. Alguns dos usos comuns são:
- Gravura em vidro: O difluoreto de amônio pode atacar o componente de sílica do vidro e criar padrões ou desenhos na superfície. Também pode remover manchas e ferrugem de vidros.
- Processamento de metais: O difluoreto de amônio pode atuar como agente complexante com certos metais e melhorar a qualidade e a aparência da galvanoplastia. Também pode remover óxidos e incrustações de superfícies metálicas.
- Produção cerâmica: utilizada como fundente na preparação de vidrados e esmaltes cerâmicos. Também pode diminuir o ponto de fusão e a viscosidade de certos materiais cerâmicos.
- Síntese orgânica: Usado como catalisador ou reagente em certas reações orgânicas, como fluoração, desproteção e clivagem.
- Digestão Mineral: Também usado como um poderoso agente de fluoração para converter certos minerais e óxidos refratários em fluoretos solúveis. Isto pode facilitar a recuperação de metais preciosos dos minérios.
Questões:
P: Qual é a densidade aparente dos sais de bifluoreto de amônio?
R: A densidade aparente dos sais de difluoreto de amônio é de 1,5 g/cm3.
P: Para que é usado o bifluoreto de amônio?
R: O difluoreto de amônio é usado para diversos fins, como gravação em vidro, processamento de metal, produção de cerâmica, síntese orgânica e digestão mineral.
P: Como gravar vidro com bifluoreto de amônio?
R: Para gravar o vidro com difluoreto de amônio, é necessário preparar uma solução de sal em água e aplicá-la na superfície do vidro com um pincel ou estêncil. A solução reagirá com o componente de sílica do vidro e criará padrões ou desenhos. É necessário enxaguar o vidro com água e secá-lo após o ataque químico.
P: O bifluoreto de amônio é seguro em rodas cromadas?
R: O difluoreto de amônio não é seguro em rodas cromadas porque pode corroer o metal e danificar o acabamento. Também pode causar queimaduras graves e lesões oculares se entrar em contato com a pele ou os olhos. Você deve evitar o uso de difluoreto de amônio em rodas cromadas e, em vez disso, usar um limpador adequado.
P: Qual é o prazo de validade do bifluoreto de amônio?
R: A vida útil do difluoreto de amônio depende das condições de armazenamento e da pureza do produto. Geralmente, pode durar vários anos se armazenado em local fresco, seco e bem ventilado, em um recipiente bem fechado. No entanto, pode absorver a umidade do ar e formar grumos ou bolos com o tempo. Você deve verificar a aparência e a qualidade do produto antes de usá-lo.
P: O bifluoreto de amônio é um ácido?
R: O difluoreto de amônio não é um ácido, mas um sal que contém um cátion de amônio ([NH4]+) e um ânion difluoreto ou hidrogênio (difluoreto) ([HF2]−). Porém, pode atuar como um composto ácido-base, pois pode liberar fluoreto de hidrogênio (HF), um ácido forte, quando aquecido ou dissolvido em água.
