O bicarbonato de lítio (LiHCO3) é um composto químico utilizado em diversas aplicações. Possui propriedades alcalinas e é utilizado em pesquisas, produtos farmacêuticos e como potencial tratamento para certas condições médicas.
| Nome IUPAC | Bicarbonato de lítio |
| Fórmula molecular | LiHCO3 |
| Número CAS | 5006-97-3 |
| Sinônimos | Hidrogenocarbonato de lítio, bicarbonato de lítio |
| InChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Propriedades do bicarbonato de lítio
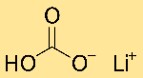
Fórmula de bicarbonato de lítio
O hidrogenocarbonato de lítio tem a fórmula química LiHCO3. Consiste em um cátion de lítio (Li), um ânion hidrogenocarbonato (HCO3) e um átomo de hidrogênio (H). A fórmula reflete a presença de íons lítio e bicarbonato no composto.
Massa molar de bicarbonato de lítio
A massa molar do hidrogenocarbonato de lítio (LiHCO3) é de aproximadamente 68 gramas por mol (g/mol). É calculado somando as massas atômicas de seus elementos constituintes: lítio, hidrogênio, carbono e oxigênio.
Ponto de ebulição do bicarbonato de lítio
O hidrogenocarbonato de lítio não tem ponto de ebulição bem definido porque se decompõe em altas temperaturas. À medida que aquece, perde dióxido de carbono (CO2) e água (H2O), transformando-se em carbonato de lítio (Li2CO3).
Ponto de fusão do bicarbonato de lítio
O hidrogenocarbonato de lítio tem um ponto de fusão de cerca de 250 graus Celsius (482 graus Fahrenheit). Nessa temperatura, ele sofre uma transição de fase do estado sólido para o líquido.
Densidade de bicarbonato de lítio g/mL
A densidade do hidrogenocarbonato de lítio (LiHCO3) é de aproximadamente 2,21 gramas por mililitro (g/mL). É um composto relativamente denso devido à presença de lítio e outros elementos pesados.
Peso molecular do bicarbonato de lítio
O hidrogenocarbonato de lítio tem um peso molecular de aproximadamente 68 g/mol. O peso molecular representa a soma dos pesos atômicos de todos os átomos em uma única molécula do composto.
Estrutura do bicarbonato de lítio
O hidrogenocarbonato de lítio tem uma estrutura cristalina. Forma uma rede de átomos de lítio, hidrogenocarbonato e hidrogênio, dispostos em um padrão repetitivo. A estrutura é mantida unida por ligações iônicas e covalentes.
Solubilidade do bicarbonato de lítio
O hidrogenocarbonato de lítio é pouco solúvel em água. Dissolve-se até certo ponto em água, dando uma solução ligeiramente alcalina. No entanto, a sua solubilidade é relativamente baixa em comparação com outros compostos de lítio.
| Aparência | Pó cristalino branco |
| Gravidade Específica | ~2,21g/mL |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | ~68 g/mol |
| Densidade | ~2,21g/mL |
| Ponto de fusão | ~250°C (482°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Ligeiramente solúvel, dando uma solução ligeiramente alcalina |
| Solubilidade | Limite |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Ligeiramente alcalino |
Segurança e perigos do bicarbonato de lítio
O hidrogenocarbonato de lítio tem certas considerações de segurança e perigos. É essencial manusear o composto com cuidado para minimizar os riscos. O contato direto com a pele ou os olhos pode causar irritação. A inalação de poeira ou vapores deve ser evitada, pois pode causar desconforto respiratório. Quando aquecido, decompõe-se, libertando dióxido de carbono e vapor de água, o que pode ser potencialmente perigoso em espaços fechados. Além disso, é crucial armazenar adequadamente o hidrogenocarbonato de lítio, longe de substâncias incompatíveis. Ventilação adequada e equipamento de proteção individual devem ser usados ao trabalhar com este composto para garantir um ambiente seguro.
| Símbolos de perigo | Não disponível |
| Descrição de segurança | Manuseie com cuidado. Evite inalação, contato com a pele e os olhos. Armazene adequadamente. Use em áreas bem ventiladas. |
| Números de identificação da ONU | Não disponível |
| Código SH | Não disponível |
| Classe de perigo | Não disponível |
| Grupo de embalagem | Não disponível |
| Toxicidade | Baixa toxicidade; manusear com depósito. |
Métodos para sintetizar bicarbonato de lítio
Vários métodos permitem a síntese de hidrogenocarbonato de lítio.
Uma abordagem comum é reagir hidróxido de lítio (LiOH) com dióxido de carbono (CO2). A reação ocorre em uma solução aquosa onde o hidróxido de lítio se dissocia em íons lítio e hidróxido. Simultaneamente, o dióxido de carbono se dissolve na água, formando ácido carbônico (H2CO3) . Os íons de lítio então reagem com o ácido carbônico para produzir hidrogenocarbonato de lítio (LiHCO3) e água (H2O). A equação química para esta reação é:
LiOH + CO2 → LiHCO3 + H2O
Outro método envolve o tratamento do carbonato de lítio (Li2CO3) com dióxido de carbono em sistema fechado, produzindo bicarbonato de lítio. A equação química para esta reação é:
Li2CO3 + CO2 → 2LiHCO3
Esses métodos de síntese são importantes para a produção de hidrogenocarbonato de lítio em laboratório e para aplicações industriais. É crucial seguir protocolos de segurança e garantir equipamentos e condições adequadas durante o processo de síntese.
Usos do bicarbonato de lítio
O hidrogenocarbonato de lítio encontra muitas aplicações devido às suas propriedades únicas. Aqui estão alguns de seus principais usos:
- Pesquisa e Laboratório: Serve como um reagente valioso em vários experimentos químicos e de pesquisa, permitindo aos cientistas estudar reações e propriedades químicas.
- Tratamento médico potencial: Estão em andamento estudos sobre seu papel potencial como tratamento para doenças como deficiência de lítio e certos distúrbios renais, bem como como agente alcalinizante.
- Aplicações ambientais: Pode contribuir para a remoção de dióxido de carbono dos processos industriais e tem aplicações potenciais na mitigação de emissões de gases com efeito de estufa.
- Agente Alcalinizante: Em processos industriais específicos, atua como agente alcalinizante para controlar a acidez e regular os níveis de pH.
- Indústria farmacêutica: As formulações farmacêuticas utilizam hidrogenocarbonato de lítio principalmente em medicamentos para transtornos de humor, como o transtorno bipolar.
- Produção de baterias de lítio: Pesquisadores e círculos experimentais estão explorando o uso de hidrogenocarbonato de lítio em baterias avançadas à base de lítio para melhorar o desempenho da bateria.
- Tratamento de Água: Os processos de tratamento de água utilizam bicarbonato de lítio para ajustar o pH das fontes de água.
- Agricultura: O hidrogenocarbonato de lítio tem utilização limitada nas práticas agrícolas, onde os agricultores o utilizam para tratar condições específicas do solo e melhorar o crescimento das plantas.
Apesar destas aplicações, é crucial manusear o hidrogenocarbonato de lítio com cuidado e seguir as precauções de segurança, dados os seus potenciais perigos e reatividade. À medida que a investigação e os avanços tecnológicos continuam, podem surgir novas utilizações para o hidrogenocarbonato de lítio, aumentando ainda mais a sua importância em vários campos.
Questões:
P: Qual é a fórmula química do bicarbonato de lítio?
R: A fórmula química do hidrogenocarbonato de lítio é LiHCO3.
P: O bicarbonato de lítio pode causar baixo teor de vitamina D?
R: Não há evidências que sugiram que o hidrogenocarbonato de lítio cause baixos níveis de vitamina D.
P: O que funciona melhor: carbonato de lítio ou bicarbonato de lítio?
R: A eficácia do carbonato de lítio ou do bicarbonato de lítio depende de suas aplicações específicas e do uso pretendido.
P: O bicarbonato de lítio interage com o extrato de valeriana?
R: Não há interações conhecidas entre o hidrogenocarbonato de lítio e o extrato de valeriana, mas a consulta com um profissional de saúde é essencial.
P: O que é bicarbonato de lítio?
R: O hidrogenocarbonato de lítio é um composto químico com propriedades alcalinas, usado em uma variedade de aplicações, incluindo pesquisa e produtos farmacêuticos.
P: O bicarbonato de lítio e o carbonato de lítio podem ser aquecidos em água?
R: O hidrogenocarbonato de lítio e o carbonato de lítio podem ser aquecidos em água, mas se decompõem para formar outros compostos.
P: Qual é a perda de peso quando 3,45g de LiHCO3 são decompostos?
R: A perda de peso quando 3,45 g de LiHCO3 são decompostos dependerá da reação específica e dos produtos formados.
P: O LiHCO3 é um eletrólito forte?
R: Não, o hidrogenocarbonato de lítio (LiHCO3) é um eletrólito fraco.
P: Que sal seria produzido pela reação de H2SO4 com LiHCO3?
R: A reação entre H2SO4 e LiHCO3 produzirá sulfato de lítio (Li2SO4), dióxido de carbono (CO2) e água (H2O).
P: O LiHCO3 é um ácido ou uma base?
R: O hidrogenocarbonato de lítio (LiHCO3) atua como base devido às suas propriedades alcalinas.
P: A N-metiletanamina reage com LiHCO3?
R: A reatividade da N-metiletanamina com LiHCO3 dependerá das condições específicas da reação e dos produtos desejados.
