O bicarbonato de cálcio (Ca(HCO3)2) é um composto que contém cálcio, carbono e oxigênio. É comumente encontrado em água mineral e é importante para a saúde óssea e função muscular.
| Nome IUPAC | Hidrogenocarbonato de cálcio |
| Fórmula molecular | Ca(HCO3)2 |
| Número CAS | 3983-19-5 |
| Sinônimos | Hidrogenocarbonato de cálcio, hidrogenocarbonato de cálcio, bicarbonato de cálcio hidratado, hidrogenocarbonato de cálcio hidratado, EINECS 223-070-3 |
| InChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Propriedades do bicarbonato de cálcio
Fórmula de bicarbonato de cálcio
A fórmula química do bicarbonato de cálcio é Ca(HCO3)2. Isso indica que o composto consiste em um íon Ca2+ e dois íons HCO3-. A fórmula é importante para compreender a composição do composto e suas propriedades químicas. O Ca(HCO3)2 pode ser formado pela dissolução do carbonato de cálcio em água gaseificada ou pela reação do hidróxido de cálcio com dióxido de carbono.
Massa molar de bicarbonato de cálcio
A massa molar do Ca(HCO3)2 é 162,114 g/mol. Isso é calculado adicionando as massas atômicas de cada elemento do composto. Ca(HCO3)2 contém átomos de cálcio, hidrogênio, carbono e oxigênio, e a massa molar reflete a massa combinada de todos esses átomos. Conhecer a massa molar é importante para determinar a quantidade de Ca(HCO3)2 necessária para reações químicas ou para determinar a concentração de uma solução.
Ponto de ebulição do bicarbonato de cálcio
Ca(HCO3)2 se decompõe antes de atingir seu ponto de ebulição. À pressão atmosférica normal, o Ca(HCO3)2 decompõe-se em carbonato de cálcio, água e dióxido de carbono a temperaturas superiores a 50°C. Portanto, não tem ponto de ebulição.
Ponto de fusão do bicarbonato de cálcio
Ca(HCO3)2 não possui um ponto de fusão distinto porque se decompõe antes de atingir seu ponto de fusão. Decompõe-se em carbonato de cálcio, água e dióxido de carbono a temperaturas superiores a 50°C. No entanto, a decomposição térmica do Ca(HCO3)2 pode ser usada para produzir óxido de cálcio, que possui um alto ponto de fusão de 2.613°C.
Densidade de bicarbonato de cálcio g/mL
A densidade do Ca(HCO3)2 é 2,21 g/mL. Isto significa que um centímetro cúbico de Ca(HCO3)2 pesa 2,21 gramas. A densidade do Ca(HCO3)2 é inferior à densidade do carbonato de cálcio, que é 2,71 g/mL. A densidade de uma substância é importante na determinação da massa de uma substância por unidade de volume e pode ser usada para calcular a concentração de uma solução.
Peso Molecular do Bicarbonato de Cálcio
O peso molecular do Ca(HCO3)2 é 162,114 g/mol. Este valor é calculado somando os pesos atômicos de cálcio, hidrogênio, carbono e oxigênio no composto. O peso molecular é importante na determinação da quantidade de Ca(HCO3)2 necessária para reações químicas e na determinação da concentração de uma solução.
Estrutura do bicarbonato de cálcio
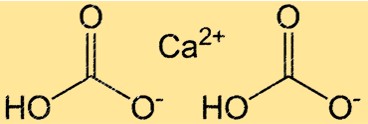
O Ca(HCO3)2 possui uma estrutura complexa devido à presença de ligações iônicas e covalentes. O composto consiste em um íon Ca2+ e dois íons HCO3- mantidos juntos por ligações iônicas. O próprio íon HCO3- é um íon poliatômico que consiste em um átomo de carbono, dois átomos de oxigênio e um átomo de hidrogênio. O átomo de carbono está duplamente ligado a um átomo de oxigênio e simples ao outro, e o átomo de hidrogênio está ligado a um dos átomos de oxigênio. A estrutura do Ca(HCO3)2 é importante para a compreensão de sua reatividade e solubilidade em água.
| Aparência | pó branco |
| Gravidade Específica | 2,21g/cm³ |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 162.114 g/mol |
| Densidade | 2,21g/ml |
| Ponto de fusão | Decompõe-se acima de 50°C |
| Ponto de ebulição | Decompõe-se acima de 50°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, insolúvel em álcool |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 6,4 – 10,3 |
| pH | 8,2 – 8,4 |
Segurança e perigos do bicarbonato de cálcio
O Ca(HCO3)2 é geralmente considerado seguro para uso em alimentos e bebidas pelas agências reguladoras. Contudo, a inalação de poeira de Ca(HCO3)2 pode causar irritação do trato respiratório. O contato com os olhos pode causar irritação ou danos à córnea. A ingestão de grandes quantidades de Ca(HCO3)2 pode causar irritação gastrointestinal. O manuseio do Ca(HCO3)2 também pode causar irritação na pele ou dermatite em indivíduos sensíveis. É importante seguir os procedimentos de manuseio adequados ao trabalhar com Ca(HCO3)2, como usar luvas e óculos de proteção. Além disso, é importante armazenar o Ca(HCO3)2 em local fresco, seco e longe de substâncias incompatíveis.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Não tóxico e seguro |
| Números de identificação da ONU | N / D |
| Código SH | 2836.50.00 |
| Classe de perigo | Não perigoso |
| Grupo de embalagem | N / D |
| Toxicidade | Não tóxico e seguro |
Métodos para a síntese de bicarbonato de cálcio
A reação do carbonato de cálcio (CaCO3) com dióxido de carbono (CO2) e água (H2O) sintetiza Ca(HCO3)2. Esta reação pode ocorrer naturalmente em certos corpos d’água, onde estão presentes dióxido de carbono e carbonato de cálcio .
Para produzir Ca(HCO3)2, o dióxido de carbono pode passar por uma solução de hidróxido de cálcio (Ca(OH)2) . Esta reação forma carbonato de cálcio , que então reage com o excesso de dióxido de carbono para formar Ca(HCO3)2.
Outro método de síntese de Ca(HCO3)2 envolve a reação de cloreto de cálcio (CaCl2) com bicarbonato de sódio (NaHCO3). Esta reação produz Ca(HCO3)2, bem como cloreto de sódio (NaCl) e dióxido de carbono.
É importante notar que o Ca(HCO3)2 é um composto relativamente instável e se decompõe em carbonato de cálcio e dióxido de carbono na presença de calor ou em condições ácidas. Para evitar a decomposição, o Ca(HCO3)2 deve ser manuseado e armazenado com cuidado.
Usos do bicarbonato de cálcio
Aqui estão alguns usos comuns de Ca(HCO3)2:
- Alimentos e Bebidas: Utilizado como aditivo alimentar na produção de determinados produtos de panificação, agentes de saída e refrigerantes.
- Tratamento de Água: Utilizado para aumentar a alcalinidade da água, o que ajuda a prevenir a corrosão das tubulações e reduzir a acidez de fontes de água ácidas.
- Agricultura: Usado como corretivo do solo para aumentar o teor de cálcio do solo, o que pode melhorar a estrutura do solo e o crescimento das plantas.
- Produtos farmacêuticos: Usados em algumas formulações antiácidos como agente neutralizante para ajudar a aliviar azia e indigestão.
- Construção: Utilizado como fonte de cálcio na produção de determinados materiais de construção, como cimento e gesso.
- Limpeza: Usado como abrasivo suave em alguns produtos de limpeza, como pasta de dente e pós de limpeza.
- Cosméticos: Usado como agente tampão em algumas formulações cosméticas para ajudar a manter o pH do produto.
Questões:
P: O que é bicarbonato de cálcio?
R: Ca(HCO3)2 é um pó cristalino branco que se forma quando o carbonato de cálcio reage com dióxido de carbono e água.
P: Quais são as três substâncias que devem interagir para formar o bicarbonato de cálcio?
R: Carbonato de cálcio, dióxido de carbono e água devem interagir para formar Ca(HCO3)2.
P: O bicarbonato de cálcio é um agente fermentador?
R: Sim, o Ca(HCO3)2 pode ser usado como agente de saída na panificação para ajudar a massa a crescer.
P: Os cristais auditivos de bicarbonato de cálcio alguma vez se dissolvem?
R: Sim, os cristais auriculares de Ca(HCO3)2 podem se dissolver por conta própria ou com tratamento, por exemplo, através do uso de certos medicamentos ou manobras.
P: Qual é o número total de moles de átomos em um mol de Ca(HCO3)2?
R: Existem 10 moles de átomos em um mol de Ca(HCO3)2.
P: Quantos átomos existem no Ca(HCO3)2?
R: Há um total de 18 átomos presentes no Ca(HCO3)2, incluindo 1 átomo de cálcio, 2 átomos de carbono, 6 átomos de hidrogênio e 9 átomos de oxigênio.
P: O que é Ca(HCO3)2?
R: Ca(HCO3)2 é a fórmula química do bicarbonato de cálcio, que é um composto formado quando o carbonato de cálcio reage com dióxido de carbono e água.
