Benzil ou C14H10O2 é um composto orgânico cristalino amarelo usado como precursor na síntese de corantes e como fotoiniciador na química de polímeros. Também pode atuar como agente redutor e é intermediário na formação do ácido benzílico.
| Nome IUPAC | 1,2-difenil-1,2-dicarboxietileno |
| Fórmula molecular | C14H10O2 |
| Número CAS | 134-81-6 |
| Sinônimos | 1,2-Difenil-1,2-propanodiona, 1,2-Difeniletanodiona, Benzil, Benzil |
| InChI | InChI=1S/C14H10O2/c15-13(14(16)17)11-6-8-12(9-7-11)10-5-3-1-2-4-6/h1-9H,10- 17H2 |
Peso Molecular Benzil
O peso molecular do benzil é 210,24 g/mol. É a soma das massas atômicas de todos os átomos de uma molécula de benzil. O peso molecular do benzil é calculado com base na sua fórmula molecular, C14H10O2.
Densidade Benzílica g/mL
A densidade do benzil é 1,20 g/mL. É a medida da massa por unidade de volume de uma substância. A densidade do Benzil é relativamente baixa, tornando-o mais fácil de manusear em comparação com outras substâncias de maior densidade.
Ponto de ebulição do benzil
O ponto de ebulição da gasolina é 350°C (662°F). É a temperatura na qual a pressão de vapor de um líquido se iguala à pressão atmosférica e o líquido se transforma em vapor. O ponto de ebulição de uma substância depende de vários fatores, como pressão, peso molecular e forças intermoleculares.
Ponto de fusão benzil
O ponto de fusão do benzil é 98°C (270°F). Esta é a temperatura na qual um sólido se transforma em líquido. O ponto de fusão do benzil é relativamente baixo, tornando-o um intermediário útil em sínteses orgânicas.
Massa molar benzílica
A massa molar de C14H10O2 é 210,24 g/mol. É a quantidade de substância que contém o mesmo número de entidades (por exemplo, átomos, moléculas, íons) que o número de entidades contidas em 12 gramas de carbono-12 puro. A massa molar do benzil é calculada com base na sua fórmula molecular, C14H10O2.
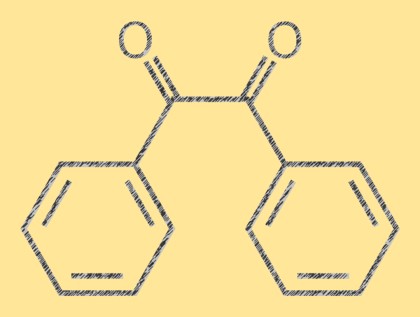
Estrutura do benzil
Benzil é um composto orgânico cristalino amarelo com a fórmula molecular C14H10O2. É uma dicetona composta por dois grupos fenil ligados a uma ligação dupla carbono-carbono central. A molécula é plana e a ligação dupla é plana. A molécula de benzil tem uma cor amarela brilhante característica que a torna útil como composto de referência em química analítica.
Fórmula Benzil
A fórmula química do benzil é C14H10O2. Representa os elementos constituintes do benzil e suas proporções relativas. A fórmula mostra que o benzil consiste em 14 átomos de carbono, 12 átomos de hidrogênio e 2 átomos de oxigênio.
RMN de benzila
C14H10O2 pode ser analisado por espectroscopia de ressonância magnética nuclear (RMN). A espectroscopia de RMN é uma ferramenta poderosa que fornece informações sobre a estrutura química e as interações das moléculas. Na espectroscopia de RMN, as propriedades magnéticas do núcleo são usadas para determinar o ambiente químico do núcleo e para obter informações sobre as ligações e deslocamentos químicos da molécula. O espectro de RMN C14H10O2 fornece informações sobre o número de prótons na molécula e o ambiente químico de cada próton, ajudando a confirmar a estrutura do C14H10O2.
| Aparência | Sólido cristalino amarelo |
| Gravidade Específica | 1,20g/ml |
| Cor | AMARELO |
| Cheiro | Inodoro |
| Massa molar | 210,24 g/mol |
| Densidade | 1,20g/ml |
| Ponto de fusão | 94,8ºC |
| Ponto de ebulição | 350°C (662°F) |
| Ponto flash | Não disponível |
| Solubilidade em Água | Ligeiramente solúvel em água |
| Solubilidade | Solúvel em etanol e éter |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não disponível |
Segurança e perigos do benzil
O C14H10O2 é considerado uma substância moderadamente tóxica e deve ser manuseado com cuidado. É altamente inflamável e deve ser mantido longe de fontes de calor e faíscas. A inalação de vapores de C14H10O2 pode causar irritação nos olhos, nariz e garganta e problemas respiratórios. O contato da pele com C14H10O2 pode causar irritação e vermelhidão na pele. A ingestão de C14H10O2 pode causar irritação estomacal e problemas digestivos. Se ingerido em grandes quantidades, pode causar problemas de saúde mais graves, como vômitos, tonturas e perda de consciência. É importante usar luvas de proteção e proteção para os olhos ao manusear o C14H10O2 e trabalhar em uma área bem ventilada para minimizar a exposição. Caso ocorram reações adversas após contato com C14H10O2, recomenda-se consultar imediatamente um médico.
| Símbolos de perigo | Inflamável |
| Descrição de segurança | S24/25 – Evitar contato com pele e olhos |
| Números de identificação da ONU | UN2024 – Mercadorias perigosas, classe de perigo 3 |
| Código SH | 2915.90.90 |
| Classe de perigo | 3 – Líquidos inflamáveis |
| Grupo de embalagem | III – Risco moderado |
| Toxicidade | Moderadamente tóxico |
Métodos de síntese de benzil
O C14H10O2 pode ser sintetizado por vários métodos, incluindo os seguintes:
- Oxidação do difenilmetanol: O difenilmetanol é oxidado usando trióxido de cromo para formar C14H10O2. Este é um método comumente usado na síntese de C14H10O2 porque é simples e econômico.
- Oxidação Wacker: Este método envolve o uso de um catalisador de paládio e um oxidante hidroperóxido para converter o alceno em C14H10O2. A reacção é geralmente realizada na presença de um solvente, tal como etanol ou água.
- Condensação Knoevenagel: Neste método, o C14H10O2 é sintetizado por uma reação entre o benzaldeído e o ácido barbitúrico na presença de uma base forte, como hidróxido de sódio ou hidróxido de potássio.
- Reação de Ullmann: Este método envolve o acoplamento de dois compostos aromáticos através de uma reação catalisada por cobre. Na síntese de C14H10O2, duas moléculas de benzaldeído reagem para formar C14H10O2.
- Oxidação de Baeyer-Villiger: Neste método, C14H10O2 é sintetizado pela oxidação da ciclohexanona em C14H10O2 na presença de um oxidante peroxiácido e uma quantidade catalítica de uma amina terciária.
A escolha do método de síntese do C14H10O2 depende de vários fatores, incluindo a disponibilidade de matéria-prima, o rendimento e a pureza desejados do produto, e o custo e o tempo envolvidos no processo de síntese.
Usos do benzil
C14H10O2 é um produto químico versátil que tem muitos usos em vários campos. Alguns dos usos comuns do C14H10O2 são:
- A produção de produtos químicos finos utiliza C14H10O2 como matéria-prima na produção de vários produtos químicos finos, incluindo antioxidantes, retardadores de chama e corantes.
- A síntese de polímeros utiliza C14H10O2 na síntese de polímeros, incluindo policarbonatos e poliuretanos, com uma ampla gama de aplicações em diversas indústrias.
- Os pesticidas usam C14H10O2 como intermediário na síntese de certos pesticidas para controlar plantações e pragas de jardim.
- Os cosméticos usam C14H10O2 como fragrância em alguns produtos cosméticos, como perfumes e colônias, para fornecer um aroma floral fresco.
- A indústria de aromas e fragrâncias utiliza C14H10O2 como ingrediente de aromas e fragrâncias para conferir um aroma amadeirado e floral a produtos alimentícios e cosméticos.
Concluindo, o C14H10O2 é um produto químico versátil que possui uma ampla gama de utilizações em diversas indústrias, incluindo as indústrias de química fina, farmacêutica e cosmética.
Questões:
O benzil é polar?
Sim, C14H10O2 é polar. Possui estrutura molecular polar devido à presença de grupos funcionais polares, como grupos carbonila (-C = O) e fenil (-C6H5). Esta estrutura polar torna o C14H10O2 solúvel em solventes polares, como água e álcoois, mas insolúvel em solventes apolares, como hidrocarbonetos. A natureza polar do C14H10O2 também permite que ele participe de várias reações polares, como ligações de hidrogênio e interações dipolo-dipolo.
Que tipo de reação ocorre a formação do ácido benzílico?
A formação de ácido C14H10O2ico a partir de C14H10O2 é um tipo de reação de rearranjo conhecida como rearranjo do ácido benzílico. Esta reação é um rearranjo do grupo carbonila em C14H10O2 para formar um novo grupo funcional ácido carboxílico no ácido benzílico. O rearranjo do ácido benzílico é um exemplo de rearranjo de Beckmann, que é um tipo de reação de substituição nucleofílica envolvendo o rearranjo de cetonas cíclicas em amidas ou ácidos carboxílicos. O mecanismo de reação envolve a formação de um intermediário cíclico, seguido pela migração do grupo carbonila e eliminação de um grupo de saída.
