O azul de bromotimol (BTB) é um indicador de pH que muda de cor de amarelo para azul na presença de uma solução básica. É comumente usado em experimentos científicos e como ferramenta de diagnóstico médico.
| Nome IUPAC | 3′,3”-dibromotimolsulfonftaleína |
| Fórmula molecular | C27H28Br2O5S |
| Número CAS | 76-59-5 |
| Sinônimos | bromotimol sulfonftaleína; 4,4′-(1,1-dioxido-3H-2,1-benzoxatiol-3,3-diil)bis(2-bromo-3-metil-6-(1-metiletil)fenol) |
| InChI | InChI=1S/C27H28Br2O5S/c1-13(2)17-11-20(15(5)23(28)18(17)7-9-19(24(20)29)8-10-21(27) 22(30)12-25(31)32)37(33,34)36-26-14(3)6-4-16(35-26)24-7-9-29-11-10-23( 24)28/h4-7,9-12,31-32H.8H2.1-3H3 |
Massa Molar Azul de Bromotimol
BTB tem massa molar de 624,38 g/mol. Massa molar é a massa de um mol de uma substância e é comumente usada em cálculos que envolvem reações químicas. A massa molar do BTB é calculada somando os pesos atômicos de todos os átomos de sua fórmula química, que é C27H28Br2O5S. Conhecer a massa molar de uma substância é importante para determinar a quantidade de substância necessária para uma determinada reação, bem como para determinar a quantidade de produto produzido em uma reação.
Ponto de ebulição do azul de bromotimol
O BTB tem um ponto de ebulição de 636,3°C a 760 mmHg. O ponto de ebulição é a temperatura na qual uma substância passa do estado líquido para o estado gasoso a uma determinada pressão. O alto ponto de ebulição do BTB indica que é um composto estável que não vaporiza ou se decompõe facilmente em condições normais. O ponto de ebulição de uma substância pode ser usado para determinar sua pureza, porque as impurezas podem alterar o ponto de ebulição.
Azul de bromotimol Ponto de fusão
O BTB tem um ponto de fusão de 165-170°C. O ponto de fusão é a temperatura na qual uma substância sólida passa do estado sólido para o estado líquido. O ponto de fusão de uma substância é utilizado para identificá-la e caracterizá-la, pois substâncias diferentes possuem pontos de fusão diferentes. O ponto de fusão do BTB é relativamente alto, indicando que é um composto estável que não se decompõe facilmente.
Densidade azul de bromotimol g/ml
O BTB tem uma densidade de 1,36 g/mL. Densidade é a massa de uma substância por unidade de volume e mede a densidade das moléculas de uma substância. A densidade do BTB indica que é um composto relativamente denso e é comumente usado como padrão em medições de densidade.
Peso molecular do azul de bromotimol
O peso molecular do BTB é 624,38 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula e é um fator importante nas reações químicas. O peso molecular do BTB é utilizado para determinar a quantidade de substância necessária para uma determinada reação, bem como para determinar a quantidade de produto produzido em uma reação.
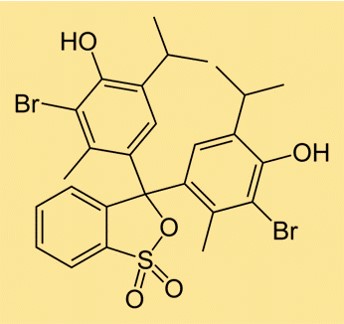
Estrutura do azul de bromotimol
A estrutura do BTB é composta por dois anéis aromáticos, cada um dos quais possui um átomo de bromo ligado. Existe também um grupo sulfonato ligado a um dos anéis, o que torna a molécula solúvel em água. A estrutura do BTB é semelhante a outros indicadores de pH, utilizados para determinar a acidez ou basicidade de uma solução.
Fórmula Azul de Bromotimol
A fórmula química do BTB é C27H28Br2O5S. A fórmula indica o número e os tipos de átomos da molécula e é usada em reações químicas para determinar a quantidade de substância necessária para uma determinada reação. A fórmula do BTB mostra que ele contém dois átomos de bromo, que lhe conferem sua cor verde-amarelada distinta em soluções ácidas, e um grupo sulfonato, que o torna solúvel em água.
| Aparência | Pó verde escuro |
| Gravidade Específica | 1,36 |
| Cor | verde amarelado |
| Cheiro | Inodoro |
| Massa molar | 624,38 g/mol |
| Densidade | 1,36 g/ml |
| Ponto de fusão | 165-170°C |
| Ponto de ebulição | 636,3°C a 760 mmHg |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em etanol, ligeiramente solúvel em éter e clorofórmio |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 6.3 |
| pH | Amarelo em pH 6,0, verde em pH 7,6, azul em pH 7,9 |
Segurança e perigos do azul de bromotimol
O BTB pode ser prejudicial se ingerido, inalado ou absorvido pela pele. Isto pode causar irritação nos olhos, pele e sistema respiratório. A ingestão pode causar irritação gastrointestinal, náuseas, vômitos e dor abdominal. A inalação de poeira ou vapor de BTB pode causar irritação respiratória, tosse e dificuldade em respirar. A substância também pode ser prejudicial à vida aquática e não deve ser descartada em fontes de água. Equipamento de proteção individual adequado, como luvas e proteção para os olhos, deve ser usado ao manusear BTB, e deve ser usado e descartado de acordo com os procedimentos e regulamentos laboratoriais apropriados.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S22: Não respirar as poeiras. S24/25: Evitar contato com a pele e os olhos. S36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequados. |
| Identificadores AN | Não regulamentado |
| Código SH | 2921.59.90 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato) = 4.500 mg/kg |
Métodos para a síntese de azul de bromotimol
Existem diferentes métodos para sintetizar BTB.
Um método comum é a reação entre o azul de timol e o bromo na presença de um catalisador ácido forte, como o ácido clorídrico. A reação prossegue pela adição eletrofílica de bromo à molécula de azul de timol, seguida pela substituição de um átomo de hidrogênio por um átomo de bromo. O composto resultante é BTB.
Outro método envolve a reação entre 2,6-dibromoindofenol e vermelho de cresol na presença de um catalisador ácido forte. A reação ocorre por substituição eletrofílica de um átomo de hidrogênio na molécula de vermelho de cresol por um átomo de bromo na molécula de 2,6-dibromoindofenol. O composto resultante é BTB.
Um terceiro método envolve a reação entre o azul de timol e o brometo de sódio na presença de hidróxido de sódio. A reação ocorre substituindo um átomo de hidrogênio na molécula de azul de timol por um átomo de bromo da molécula de brometo de sódio. O composto resultante é BTB.
Independentemente do método utilizado, o produto resultante deve ser purificado por recristalização ou cromatografia em coluna para obter BTB puro.
Usos do azul de bromotimol
O BTB tem diversas aplicações em diversos campos. Alguns dos usos do BTB incluem:
- Indicador: Utilizado como indicador ácido-base, com faixa de pH de 6,0 a 7,6. Em pH 6,0 é amarelo, em pH 7,6 é verde e em pH 7,9 é azul.
- Experimentos de Laboratório: Usado em vários experimentos de laboratório para testar a presença de dióxido de carbono e outros gases e para determinar o quociente respiratório.
- Aquicultura: Usado na aquicultura para monitorar os níveis de pH da água em aquários e lagoas.
- Área Médica: Usado para testar a presença de bile em amostras de urina e para detectar a presença de infecções fúngicas.
- Educação: Usado na educação como auxílio visual para demonstrar os princípios das reações ácido-base e para ensinar os alunos sobre os níveis de pH.
- Indústria Agrícola: Usado para medir os níveis de pH do solo, um fator importante na determinação da saúde e do crescimento das plantas.
- Testes Ambientais: Utilizados em testes ambientais para medir os níveis de pH de fontes de água, como lagos e rios, para garantir sua adequação à vida aquática.
No geral, o BTB é um composto versátil com muitas aplicações em diversos campos.
Questões:
P: O que é azul de bromotimol?
R: BTB é um indicador de pH comumente usado em experimentos de laboratório e diversas outras aplicações. É um composto químico que muda de cor dependendo da acidez ou alcalinidade de uma solução.
P: Qual é a faixa de pH do azul de bromotimol?
R: A faixa de pH do BTB está entre 6,0 e 7,6. Em pH 6,0 é amarelo, em pH 7,6 é verde e em pH 7,9 é azul.
P: Qual é a mudança de cor do azul de bromotimol?
R: A mudança de cor do BTB depende do pH da solução. Em pH 6,0 é amarelo, em pH 7,6 é verde e em pH 7,9 é azul.
P: O azul de bromotimol é um ácido ou uma base? R: O BTB não é um ácido nem uma base. É um indicador que muda de cor dependendo da acidez ou alcalinidade de uma solução.
