O que é amônia?
Amônia ou NH3 é um gás incolor e pungente composto de nitrogênio e hidrogênio, amplamente utilizado na indústria como refrigerante, agente de limpeza e fertilizante.
| Nome IUPAC | Amônia |
| Fórmula molecular | NH3 |
| Número CAS | 7664-41-7 |
| Sinônimos | Azane, trihidreto de nitrogênio, álcool Hartshorn |
| InChI | InChI=1S/NH3/c1-2 |
Propriedades da amônia
Estrutura de Lewis para amônia
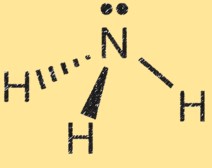
A estrutura de Lewis da amônia (NH3) mostra o arranjo dos elétrons na molécula. Em uma estrutura de Lewis, os pontos representam os elétrons e as linhas representam as ligações entre os átomos.
A estrutura de Lewis da amônia mostra o átomo de nitrogênio cercado por três átomos de hidrogênio e um par de elétrons compartilhados entre os átomos de nitrogênio e hidrogênio. Isso representa as ligações covalentes na molécula. O átomo de nitrogênio possui cinco elétrons de valência e os átomos de hidrogênio possuem cada um um elétron de valência. Na estrutura de Lewis da amônia, o átomo de nitrogênio forma três ligações simples com os átomos de hidrogênio e possui um par de elétrons não compartilhado.
Fórmula de Amônia
A fórmula química da amônia é NH3. A fórmula indica que existem três átomos de hidrogênio e um átomo de nitrogênio em cada molécula de amônia. A fórmula representa a composição da substância e fornece informações importantes sobre suas propriedades e comportamento.
Massa molar de NH3
A massa molar de uma substância é a massa de um mol da substância e é expressa em gramas por mol. A massa molar da amônia (NH3) é 17,0307 g/mol. Isso significa que um mol de amônia tem massa de 17,0307 gramas. A massa molar de uma substância é importante na determinação do número de moles em uma determinada amostra e pode ser usada para determinar a massa da fórmula de um composto.
Ponto de ebulição da amônia
NH3 tem um ponto de ebulição de -33,34°C (-28,012°F). O ponto de ebulição de uma substância é a temperatura na qual sua pressão de vapor se iguala à pressão atmosférica e ela começa a mudar de líquido para gás. O ponto de ebulição do NH3 é relativamente baixo em comparação com outros produtos químicos, tornando-o um refrigerante útil em sistemas de refrigeração e refrigeração.
Ponto de fusão NH3
NH3 tem um ponto de fusão de -77,73°C (-107,87°F). O ponto de fusão de uma substância é a temperatura na qual ela passa de sólido para líquido. O baixo ponto de fusão do NH3 o torna um refrigerante útil, pois pode ser facilmente condensado de gás para líquido, permitindo-lhe absorver calor à medida que muda de estado.
Densidade NH3 g/ml
A densidade de uma substância é a massa de uma amostra por unidade de volume. A densidade do NH3 é 0,769 g/mL. Isso significa que um mililitro de NH3 tem massa de 0,769 gramas. A densidade de uma substância pode ser usada para determinar a quantidade de matéria presente em um determinado volume e é uma propriedade importante para a compreensão de como uma substância se comporta em diferentes estados.
Peso molecular NH3
O peso molecular de uma substância é a soma dos pesos atômicos de todos os átomos de uma única molécula da substância. O peso molecular do NH3 (NH3) é 17,0307 g/mol. Isto significa que uma molécula de NH3 tem um peso molecular de 17,0307 gramas por mol. O peso molecular de uma substância é importante na determinação do número de moles em uma determinada amostra e pode ser usado para determinar a massa da fórmula de um composto.
Estrutura NH3
NH3 é uma molécula composta por três átomos de hidrogênio e um átomo de nitrogênio. O átomo de nitrogênio está ligado aos átomos de hidrogênio por meio de uma ligação covalente e a molécula tem uma forma de pirâmide trigonal. Os ângulos de ligação na molécula são de aproximadamente 107°. NH3 é uma molécula polar, o que significa que tem uma extremidade positiva e negativa, e é comumente usada como solvente e reagente em reações químicas.
| Aparência | Gás incolor |
| Gravidade Específica | 0,59 (ar = 1) |
| Cor | Incolor |
| Cheiro | Odor pungente e forte |
| Massa molar | 17,0307 g/mol |
| Densidade | 0,769g/mL |
| Ponto de fusão | -77,73ºC |
| Ponto de ebulição | -33,34ºC |
| Ponto flash | Não aplicável (gás) |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e na maioria dos solventes orgânicos |
| Pressão de vapor | 50,7kPa a 20°C |
| Densidade do vapor | 0,59 (ar = 1) |
| pKa | 4,75 |
| pH | 11,6 (solução saturada) |
Segurança e perigos da amônia
O NH3 é um gás altamente tóxico e corrosivo que pode prejudicar gravemente a saúde humana e o meio ambiente se não for manuseado adequadamente. O NH3 pode causar queimaduras graves nos olhos, pele e trato respiratório, podendo também ser fatal se inalado em altas concentrações. Além disso, o NH3 é muito reativo e pode pegar fogo ou explodir se entrar em contato com certos produtos químicos ou materiais.
É importante tomar precauções de segurança ao manusear ou trabalhar com NH3. Isso inclui o uso de roupas de proteção, como luvas, óculos de proteção e máscara facial, além de fornecer ventilação adequada para evitar a inalação do gás. Também é importante armazenar o NH3 em áreas bem ventiladas, longe de fontes de calor e outros materiais inflamáveis. Se exposto ao NH3, é importante retirar as roupas contaminadas e enxaguar a área afetada com bastante água. Procure atendimento médico imediatamente se aparecerem sintomas de exposição.
| Símbolos de perigo | T +, N |
| Descrição de segurança | Perigoso para o ambiente, nocivo por inalação, irritante |
| Identificadores AN | ONU 1005 |
| Código SH | 2814.1 |
| Classe de perigo | 2.3 |
| Grupo de embalagem | II |
| Toxicidade | Dose altamente tóxica e fatal (inalação) – 33-66 ppm |
Métodos de síntese de amônia
Existem vários métodos para sintetizar amônia, incluindo o processo Haber, o processo Ostwald e o processo Birkeland-Eyde.
O processo Haber, também conhecido como processo Haber-Bosch, é o método mais utilizado para a síntese industrial de amônia. Neste processo, o gás nitrogênio do ar reage com o gás hidrogênio sobre um catalisador de ferro para formar amônia. A reação ocorre sob alta pressão (cerca de 150 atmosferas) e a uma temperatura de 450-500°C. O processo Haber é muito eficiente, produzindo grandes quantidades de amônia com alto rendimento, e é utilizado como fonte primária de amônia para a produção de fertilizantes e outros produtos químicos.
O processo Ostwald, também conhecido como processo de fixação de nitrogênio, é um método mais antigo de síntese de amônia que envolve a oxidação do gás nitrogênio em óxido nítrico, seguida pela reação do óxido nítrico com mais gás nitrogênio para formar amônia. Este processo é menos eficiente e foi amplamente substituído pelo processo Haber.
O processo Birkeland-Eyde, também conhecido como processo de plasma, é um método mais recente de síntese de amônia que utiliza uma descarga de plasma para dissociar os gases nitrogênio e hidrogênio e formar amônia. Este processo ainda está em fase de desenvolvimento e não foi amplamente adotado para uso industrial.
Em resumo, o processo Haber é o método mais utilizado para a síntese de amônia, enquanto o processo Ostwald e o processo Birkeland-Eyde são métodos mais antigos ou menos utilizados.
Usos da amônia
A amônia é um produto químico versátil que possui uma ampla gama de utilizações na indústria e na agricultura. Alguns dos principais usos da amônia incluem:
- Produção de fertilizantes: Principal ingrediente na produção de fertilizantes nitrogenados, a amônia aumenta o rendimento das colheitas e melhora a fertilidade do solo.
- Refrigeração: Os sistemas de refrigeração industrial e doméstica utilizam amônia como refrigerante, incluindo refrigeradores e freezers.
- Limpeza: Os produtos de limpeza doméstica geralmente contêm amônia devido à sua capacidade de dissolver gordura e sujeira.
- Produtos farmacêuticos: A produção de diversos produtos farmacêuticos, como antiácidos e xaropes para tosse, utiliza amônia como matéria-prima.
- Produção têxtil: O tingimento e estamparia têxtil, bem como a produção de fibras sintéticas, utilizam amônia.
- Tratamento de resíduos: O tratamento de águas residuais e o controle de odores de estações de tratamento de esgoto envolvem o uso de amônia.
- Retardadores de chama: A amônia atua como retardador de chama na produção de materiais como plásticos, borrachas e outros.
- Produção de petróleo e gás: A indústria de petróleo e gás utiliza amônia para produzir vários produtos químicos, incluindo surfactantes e desemulsificantes.
Concluindo, a amônia é um produto químico versátil que tem uma ampla gama de utilizações em diversas indústrias e aplicações, incluindo agricultura, refrigeração, limpeza, farmacêutica, produção têxtil, tratamento de resíduos, retardadores de chama e produção de petróleo e gás.
Questões:
A amônia é um ácido ou uma base?
A amônia é considerada uma base. Em soluções aquosas, dissolve-se para formar íons hidróxido (OH-) e atua como uma base fraca. A amônia tem um pH básico (alcalino), geralmente em torno de 11. As soluções de amônia podem neutralizar ácidos para formar sal e água, que é uma das características que definem uma base. Nas reações químicas, a amônia também pode atuar como nucleófilo e participar de reações que formam amidas, que são derivadas da amônia e contêm a ligação nitrogênio-carbono característica de aminas e amidas.
A amônia é polar?
Sim, a amônia é polar. Possui uma geometria molecular curva com um átomo central de nitrogênio rodeado por três átomos de hidrogênio. Esta forma cria um momento dipolo permanente, com a extremidade positiva do dipolo localizada nos átomos de hidrogênio e a extremidade negativa localizada no átomo de nitrogênio. A natureza polar da amônia permite que ela se dissolva em solventes polares como a água, o que é uma característica das moléculas polares. A natureza polar da amônia também permite que ela participe das ligações de hidrogênio, que é um tipo de força intermolecular que ocorre entre moléculas polares. Esta ligação de hidrogênio pode levar a pontos de ebulição e fusão mais elevados do que moléculas apolares de tamanho semelhante.
