O ácido oxálico é um composto orgânico incolor e inodoro encontrado em muitos vegetais e frutas. É utilizado em diversos processos industriais, como limpeza e polimento de metais. Também pode ser prejudicial se ingerido em grandes quantidades.
| Nome IUPAC | Ácido etanodióico |
| Fórmula molecular | C2H2O4 |
| Número CAS | 144-62-7 |
| Sinônimos | Ácido etanodióico, ácido de açúcar, ácido oxírico, alvejante de madeira, ácido alazão, ácido C2dicarboxílico, etc. |
| InChI | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
Propriedades do ácido oxálico
Fórmula de Ácido Oxálico
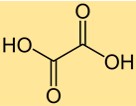
A fórmula química do ácido oxálico é C2H2O4. Consiste em dois átomos de carbono, dois átomos de oxigênio e quatro átomos de hidrogênio. A fórmula do ácido oxálico é importante em muitos cálculos químicos, como a determinação do peso molecular ou do número de moles de ácido oxálico em uma amostra. A fórmula também fornece informações sobre a proporção de átomos presentes na molécula.
Massa molar de ácido oxálico
A massa molar do ácido etanodióico é 90,03 g/mol. Isso é calculado somando as massas atômicas de cada elemento presente na molécula (2 átomos de carbono, 2 átomos de oxigênio e 4 átomos de hidrogênio). A massa molar do ácido etanodióico é importante em muitos cálculos químicos, como a determinação da quantidade de ácido etanodióico necessária para uma reação específica ou a concentração de uma solução de ácido etanodióico.
Ponto de ebulição do ácido oxálico
O ponto de ebulição do ácido etanodióico é 365°C. A esta temperatura, a fase líquida do ácido etanodióico transforma-se na fase vapor e torna-se gasosa. O ponto de ebulição do ácido etanodióico é influenciado por vários fatores como pressão, pureza e presença de impurezas. O ácido oxálico é relativamente estável em altas temperaturas, mas a exposição prolongada ao calor pode causar sua decomposição e produção de dióxido de carbono e água.
Ponto de fusão do ácido oxálico
O ponto de fusão do ácido etanodióico é 189-191°C. Esta é a temperatura na qual o ácido etanodióico sólido começa a liquefazer-se e a tornar-se líquido. O ponto de fusão do ácido etanodióico pode ser afetado por vários fatores, como pureza, pressão e estrutura cristalina. O ponto de fusão é uma propriedade física importante do ácido etanodióico porque ajuda a determinar sua adequação para diversas aplicações.
Densidade de ácido oxálico g/ml
A densidade do ácido etanodióico é 1,90 g/ml. Isso significa que um mililitro de ácido etanodióico pesa 1,90 gramas. A densidade do ácido etanodióico pode variar dependendo da temperatura, pressão e concentração da solução. A densidade do ácido etanodióico é uma propriedade importante usada em muitos processos químicos e industriais, como determinar a quantidade de ácido etanodióico necessária para uma reação ou calcular o volume de uma solução.
Peso molecular do ácido oxálico
O peso molecular do ácido etanodióico é 90,03 g/mol. É a soma dos pesos atômicos de todos os átomos da molécula. O peso molecular do ácido etanodióico é usado em vários cálculos químicos, como a determinação do número de moles de ácido etanodióico em uma determinada amostra ou a concentração de uma solução de ácido etanodióico.
Estrutura do ácido oxálico
O ácido oxálico tem uma estrutura de ácido di-carboxílico, com dois grupos carboxila (-COOH) ligados a um átomo de carbono central. A molécula possui uma estrutura plana, com os dois grupos carboxila orientados perpendicularmente. A estrutura do ácido oxálico torna-o um ácido orgânico forte, capaz de doar dois prótons em uma solução.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 1,90 g/mL a 20°C |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 90,03 g/mol |
| Densidade | 1,90 g/mL a 20°C |
| Ponto de fusão | 189-191°C |
| Ponto de ebulição | 365°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 90 g/L a 20°C |
| Solubilidade | Solúvel em água, álcool, éter e glicerol |
| Pressão de vapor | 0,0001 mmHg a 25°C |
| Densidade do vapor | 3,3 (ar=1) |
| pKa | pKa1=1,25, pKa2=4,14 |
| pH | 1,2 (solução 0,1M) |
Segurança e perigos do ácido oxálico
O ácido oxálico é uma substância perigosa que pode ser prejudicial se não for manuseada adequadamente. Pode ser corrosivo para a pele, olhos e sistema respiratório e causar irritação ou queimaduras ao contato. A inalação de poeira ou vapor de ácido etanodióico também pode causar irritação respiratória e danos aos pulmões. Ao manusear o ácido etanodióico, é importante usar equipamentos de proteção individual adequados, como luvas, óculos de proteção e respirador. Além disso, deve ser armazenado em local fresco e seco, longe de fontes de calor e ignição. A eliminação do ácido etanodióico deve ser realizada de acordo com os regulamentos locais.
| Símbolos de perigo | T, C |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Use roupas de proteção adequadas, luvas e proteção para os olhos/face. Em caso de contato com os olhos, lavar imediatamente com água em abundância e enxaguar com médico. Em caso de acidente ou indisposição, procure imediatamente atendimento médico (se possível mostre o rótulo). |
| Identificadores AN | UN3261 |
| Código SH | 291711 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | LD50 oral: 750 mg/kg (rato), LD50 dérmico: 1000 mg/kg (coelho), LC50 por inalação: 1100 ppm/8h (rato) |
Métodos de síntese de ácido oxálico
Existem vários métodos para sintetizar o ácido oxálico (ácido etanodióico), incluindo a oxidação de carboidratos, a oxidação do etilenoglicol e a reação do monóxido de carbono com hidróxido de sódio .
Um dos métodos mais comuns é oxidar carboidratos com ácido nítrico. A hidrólise de carboidratos produz monossacarídeos, que então oxidamos usando ácido nítrico e um catalisador como o pentóxido de vanádio. Após tratar a mistura resultante com carbonato de cálcio, tratamos com ácido sulfúrico para liberar ácido etanodióico.
Outro método de síntese de ácido etanodióico é a oxidação do etilenoglicol usando ácido nítrico e um catalisador como platina ou paládio. Oxidamos o etilenoglicol em ácido glicólico e depois o oxidamos em ácido etanodióico usando ácido nítrico e um catalisador. Em seguida, tratamos a mistura resultante com carbonato de cálcio e ácido sulfúrico para liberar ácido etanodióico.
Um terceiro método de síntese de ácido etanodióico envolve a reação de monóxido de carbono com hidróxido de sódio na presença de um catalisador como níquel ou cobalto. A reação do monóxido de carbono com hidróxido de sódio produz formato de sódio, que então reagimos com hidróxido de sódio para produzir oxalato de sódio. O tratamento do oxalato de sódio com ácido sulfúrico libera ácido etanodióico.
Usos do ácido oxálico
O ácido oxálico tem muitos usos diferentes em diversas indústrias devido às suas propriedades químicas únicas. Aqui estão alguns usos comuns do ácido etanodióico:
- Remoção de ferrugem: comumente usado como removedor de ferrugem para superfícies metálicas, incluindo ferro, aço e cobre.
- Alvejante: Utilizado na indústria têxtil para branquear tecidos e fibras.
- Carpintaria: Usado para remover manchas de madeira, como manchas de água ou manchas causadas por ferro ou outros metais.
- Agente de limpeza: Utilizado como agente de limpeza para diversas superfícies, incluindo utensílios de banheiro e cozinha, bancadas e pisos.
- Agente quelante: Também utilizado como agente quelante em diversos processos industriais, incluindo a produção de cerâmica e produtos farmacêuticos.
- Condicionador: Usado como decapante na indústria eletrônica para remover óxidos metálicos e impurezas de superfícies semicondutoras.
- Fotografia: Usado em fotografia como agente revelador para certos tipos de filmes fotográficos.
- Usos médicos: Usado em alguns tratamentos médicos, incluindo a remoção de depósitos de cálcio do corpo e o tratamento de infecções do trato urinário.
Questões:
P: Onde posso comprar ácido oxálico perto de mim?
R: O ácido oxálico pode ser adquirido em muitas lojas de ferragens, lojas de materiais de construção e varejistas online. Também pode estar disponível em lojas especializadas em produtos químicos.
P: Como posso neutralizar o ácido oxálico nos alimentos?
R: O ácido oxálico pode ser neutralizado nos alimentos pela adição de uma substância rica em cálcio, como leite ou queijo. O cálcio se liga ao ácido oxálico, reduzindo seu efeito no corpo.
P: Qual é a porcentagem em massa de carbono no ácido oxálico, H2C2O4?
R: O peso molecular do ácido oxálico é 90,03 g/mol. A massa de carbono em um mol de ácido etanodióico é 24,02 g. Portanto, a porcentagem em massa de carbono no ácido etanodióico é (24,02 g/90,03 g) x 100% = 26,66%.
P: Como posso reduzir o ácido oxálico no espinafre?
R: O ácido oxálico pode ser reduzido no espinafre escaldando-o antes de consumi-lo. Este processo envolve ferver o espinafre por um curto período de tempo e depois resfriá-lo em água gelada para reduzir o teor de ácido etanodióico.
P: Qual é a porcentagem em massa de carbono no ácido oxálico, H2C2O4?
R: O peso molecular do ácido oxálico é 90,03 g/mol. A massa de carbono em um mol de ácido etanodióico é 24,02 g. Portanto, a porcentagem em massa de carbono no ácido etanodióico é (24,02 g/90,03 g) x 100% = 26,66%.
P: O H2C2O4 é um ácido ou uma base?
R: H2C2O4 é um ácido, também conhecido como ácido etanodióico.
P: Qual é a ordem de reação do H2C2O4? R: A ordem da reação do H2C2O4 depende da reação específica em questão. Pode ser determinado experimentalmente usando métodos como o método da taxa inicial ou leis de taxas integradas.
