O ácido nítrico (HNO3) é um ácido inorgânico forte e altamente reativo. É utilizado em fertilizantes, explosivos e na indústria de tingimento e estamparia têxtil. Também forma nitratos, que desempenham um papel importante nos processos biológicos e nas reações de combustão.
| Nome IUPAC | Ácido nítrico |
| Fórmula molecular | HNO3 |
| Número CAS | 7697-37-2 |
| Sinônimos | Aqua fortis, Espírito de nitro, Ácido nitroso |
| InChI | InChI=1S/HNO3/c2-1(3)4 |
Propriedades do ácido nítrico
Massa molar de ácido nítrico
A massa molar do ácido nítrico é 63,01 g/mol. É a quantidade de substância que contém o mesmo número de entidades (como átomos, moléculas ou íons) que 12 gramas de carbono-12 puro.
Fórmula de Ácido Nítrico
A fórmula química do ácido nítrico é HNO<sub>3</sub>. Representa o número e tipo de átomos na molécula. A fórmula pode ser usada para prever suas propriedades físicas e químicas, como ponto de ebulição, ponto de fusão e densidade.
Ponto de ebulição do ácido nítrico
O ponto de ebulição do ácido nítrico é 83,0°C (181,4°F). É a temperatura na qual uma substância passa de líquido para gás a uma determinada pressão. O ácido nítrico é uma substância altamente reativa e volátil, e o ponto de ebulição ajuda a determinar as condições sob as quais deve ser manuseado e armazenado.
Ponto de fusão do ácido nítrico
O ponto de fusão do ácido nítrico é -41,5°C (-42,7°F). É a temperatura na qual uma substância sólida muda de estado para líquido. O baixo ponto de fusão do ácido nítrico facilita o manuseio na forma líquida.
Densidade de ácido nítrico g/ml
A densidade do ácido nítrico é 1,51 g/mL. É uma medida da quantidade de massa por unidade de volume de uma substância. A densidade do ácido nítrico pode ajudar a determinar os seus requisitos de armazenamento e manuseamento, bem como o seu potencial para reagir com outras substâncias.
Peso molecular do ácido nítrico
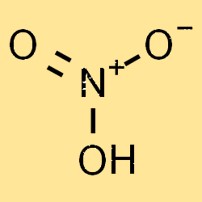
O peso molecular do ácido nítrico é 63,01 g/mol. É a soma dos pesos atômicos dos átomos individuais da molécula. O peso molecular do ácido nítrico é um fator importante na determinação de suas propriedades físicas e químicas.
Estrutura do ácido nítrico
O ácido nítrico é um líquido incolor, altamente reativo e volátil. Sua estrutura molecular consiste em um átomo de nitrogênio, um átomo de hidrogênio e três átomos de oxigênio, formando a fórmula química HNO3. Os átomos de oxigênio estão dispostos em um arranjo trigonal planar em torno do átomo de nitrogênio.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,51g/ml |
| Cor | Incolor |
| Cheiro | Odor pungente e pungente |
| Massa molar | 63,01 g/mol |
| Densidade | 1,51g/ml |
| Ponto de fusão | -41,5°C (-42,7°F) |
| Ponto de ebulição | 83,0°C (181,4°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel em álcool, éter e outros solventes polares |
| Pressão de vapor | Criado em temperatura ambiente |
| Densidade do vapor | 1,48 (ar = 1) |
| pKa | -1,3 |
| pH | 1 (solução a 10%) |
Nota: O ponto de inflamação do ácido nítrico não é aplicável porque é um líquido. O pH de uma solução de ácido nítrico a 10% é 1, o que indica que é um ácido forte. O pKa é o logaritmo negativo da constante de dissociação do ácido, que é uma medida da força de um ácido em solução.
Segurança e perigos do ácido nítrico
O ácido nítrico é uma substância altamente reativa e corrosiva que pode causar ferimentos graves ou morte se não for manuseada adequadamente. Isso pode causar queimaduras, lesões oculares e irritação respiratória. Equipamento de proteção adequado, como luvas e óculos de proteção, deve ser usado ao manusear ácido nítrico. As áreas de armazenamento devem ser bem ventiladas e os derramamentos devem ser limpos imediatamente para evitar a liberação de vapores tóxicos. Em caso de contato com a pele ou olhos, lave a área afetada com água por pelo menos 20 minutos e procure atendimento médico imediatamente.
| Símbolos de perigo | Perigoso para o meio ambiente, Oxidante, Nocivo, Irritante |
| Descrição de segurança | S2 – Manter fora do alcance das crianças. S23 – Não respirar os fumos. S24/25 – Evitar contato com pele e olhos. S26 – Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico. |
| Números de identificação da ONU | ONU 2031 |
| Código SH | 2811.90.90 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | Muito tóxico por ingestão e inalação. Pode causar queimaduras graves e lesões oculares, bem como irritação respiratória. |
Métodos de síntese de ácido nítrico
O ácido nítrico pode ser sintetizado por vários métodos, incluindo:
- Processo Ostwald: Este método envolve a oxidação da amônia com ar para formar óxido nítrico, que é então oxidado em ácido nítrico.
- Nitração de tolueno: Este método envolve a nitração do tolueno para formar nitro-tolueno, que é então oxidado para formar ácido nítrico.
- Decomposição térmica do nitrato de amônio: Este método envolve o aquecimento do nitrato de amônio para produzir óxido nítrico, que é então oxidado para formar ácido nítrico.
- Oxidação Direta de Amônia : Este método envolve a oxidação direta de amônia com oxigênio para produzir ácido nítrico.
- Eletrólise de nitrato de sódio: Este método envolve a eletrólise do nitrato de sódio para produzir ácido nítrico.
Esses métodos variam em eficácia, custo e impacto ambiental, e a escolha do método depende do uso final desejado e da escala de produção.
Usos do ácido nítrico
O ácido nítrico tem uma ampla gama de utilizações em diversas indústrias, incluindo:
- Fertilizante: O ácido nítrico é utilizado na produção de fertilizantes nitrogenados, como nitrato de amônio e sais de ácido nítrico.
- Produtos farmacêuticos: O ácido nítrico é usado como reagente na produção de produtos farmacêuticos e outros intermediários químicos.
- Explosivos: O ácido nítrico é utilizado na produção de explosivos, como dinamite e nitrocelulose.
- Processamento de metais: O ácido nítrico é usado para decapagem, limpeza e gravação de metais, incluindo aço, cobre e alumínio.
- Tingimento e Estamparia: Utilizado como mordente em processos de tingimento e estamparia.
- Tratamento de Água: O ácido nítrico é usado no tratamento de água para controlar os níveis de pH e remover impurezas.
- Pesquisa e desenvolvimento: O ácido nítrico é usado como reagente de laboratório para diversas reações e análises químicas.
No geral, o ácido nítrico tem uma gama versátil de aplicações devido às suas propriedades ácidas e oxidantes, tornando-o um produto químico crucial em diversos processos industriais.
Questões:
O ácido nítrico é um ácido forte ou um ácido fraco?
Sim, o ácido nítrico (HNO3) é considerado um ácido forte. Ácidos fortes dissociam-se completamente em água para produzir íons hidrogênio (H+), o que significa que se tornam completamente ionizados. Em contraste, os ácidos fracos ionizam apenas parcialmente na água, o que significa que não se dissociam completamente.
Numa solução de ácido nítrico, quase todas as moléculas terão doado um íon de hidrogênio, tornando-se um poderoso doador de prótons. Como resultado, o ácido nítrico tem uma alta concentração de íons hidrogênio e um pH baixo, geralmente em torno de 1-2. A força de um ácido é determinada pela sua capacidade de doar íons de hidrogênio e o ácido nítrico é um dos ácidos mais fortes na lista dos ácidos fortes.
Observe que o ácido nítrico (HNO3) tem um forte efeito oxidante e representa risco de queimaduras graves e reações químicas. Manuseie o ácido nítrico com cuidado e use equipamento de proteção adequado.
