O ácido láctico é produzido pelos músculos durante exercícios extenuantes, causando fadiga. Também é encontrado em alimentos fermentados como iogurte e é usado em produtos para esfoliação da pele.
| Nome IUPAC | ácido 2-hidroxipropanóico |
| Fórmula molecular | C3H6O3 |
| Número CAS | 50-21-5 |
| Sinônimos | Ácido lácteo, ácido 2-hidroxipropiônico, ácido DL-láctico |
| InChI | InChI=1S/C3H6O3/c1-2(4)3(5)6/h2.4H,1H3,(H.5.6) |
Propriedades do ácido láctico
Fórmula de ácido láctico
A fórmula química do ácido do leite é C3H6O3. Consiste em três átomos de carbono, seis átomos de hidrogênio e três átomos de oxigênio. Esta fórmula representa o arranjo e os tipos de átomos presentes em uma molécula de ácido lácteo.
Massa molar de ácido láctico
A massa molar do ácido láctico é de aproximadamente 90,08 gramas por mol. É calculado somando as massas atômicas de todos os átomos presentes em uma molécula de ácido láctico.
Ponto de ebulição do ácido láctico
O ácido láctico tem um ponto de ebulição de cerca de 122 a 135 graus Celsius. A esta temperatura, o ácido do leite passa do estado líquido para o gasoso. O ponto de ebulição pode variar dependendo da pureza e concentração do ácido do leite.
Ponto de fusão do ácido láctico
O ponto de fusão do ácido do leite é de cerca de 17 a 18 graus Celsius. A esta temperatura, o ácido do leite sofre uma mudança de fase de sólido para líquido. O ponto de fusão pode variar ligeiramente dependendo da forma específica do ácido do leite.
Densidade de ácido láctico g/mL
A densidade do ácido do leite é de aproximadamente 1,2 gramas por mililitro (g/mL). Este valor de densidade indica a massa de ácido lácteo presente em um determinado volume. Esta é uma característica importante usada para determinar a concentração de soluções ácidas do leite.
Peso molecular do ácido láctico
O peso molecular do ácido do leite é de aproximadamente 90,08 gramas por mol. Representa a soma dos pesos atômicos de todos os átomos de uma molécula de ácido lácteo. O peso molecular é usado em vários cálculos e análises químicas.
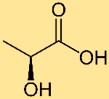
Estrutura do ácido láctico
O ácido láctico tem uma estrutura que consiste em três átomos de carbono ligados entre si numa cadeia, com um grupo hidroxila (-OH) ligado a um carbono e um grupo carboxila (-COOH) ligado a outro carbono. Esta estrutura é responsável pelas propriedades ácidas do ácido láctico.
Solubilidade do ácido láctico
O ácido láctico é solúvel em água e forma uma solução límpida e incolor. Dissolve-se facilmente devido à sua capacidade de formar ligações de hidrogênio com moléculas de água. A solubilidade do ácido do leite pode variar dependendo de fatores como temperatura e concentração.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,2 g/ml |
| Cor | Incolor |
| Cheiro | Odor levemente ácido |
| Massa molar | 90,08 g/mol |
| Densidade | 1,2 g/ml |
| Ponto de fusão | 17-18ºC |
| Ponto de ebulição | 122-135°C |
| Ponto flash | 79ºC |
| Solubilidade em Água | Totalmente miscível |
| Solubilidade | Solúvel em etanol, água e éter |
| Pressão de vapor | 3,03 mmHg a 25°C |
| Densidade do vapor | 2,55 (ar=1) |
| pKa | 3,86 |
| pH | Cerca de 2,4-3,4 |
Segurança e perigos do ácido láctico
O ácido do leite apresenta algumas preocupações e perigos de segurança. É considerado um irritante leve para a pele, olhos e sistema respiratório. O contato direto pode causar irritação, vermelhidão e desconforto. A ingestão de ácido lácteo concentrado pode causar dores abdominais, náuseas e vômitos. É importante manusear o ácido do leite com cuidado e usar medidas de proteção adequadas, como luvas e óculos de proteção. Em caso de contato com a pele ou olhos, recomenda-se enxaguar com água em abundância. Além disso, deve ser fornecida ventilação adequada ao trabalhar com ácido lácteo para evitar a inalação de vapores.
| Símbolos de perigo | Corrosivo (C), Irritante (Xi) |
| Descrição de segurança | Use luvas de proteção e proteção para os olhos/face. Evite respirar vapores. Evite a liberação no meio ambiente. |
| Números de identificação da ONU | UN3265 |
| Código SH | 2918.12.00 |
| Classe de perigo | Classe 8 (corrosivo) |
| Grupo de embalagem | GE III |
| Toxicidade | O ácido láctico é considerado de baixa toxicidade aguda. Isso pode causar irritação e queimaduras na pele e nos olhos. A inalação de vapores pode causar irritação respiratória. A ingestão de ácido lácteo concentrado pode causar irritação gastrointestinal. O manuseio adequado e as precauções de segurança devem ser seguidas para minimizar riscos potenciais. |
Métodos de síntese de ácido láctico
Existem vários métodos para sintetizar o ácido láctico.
Um método comum é a fermentação de carboidratos pelas bactérias ácidas do leite. Durante este processo, os microrganismos convertem açúcares, como glicose ou lactose, em ácido láctico através do metabolismo anaeróbico. Essa fermentação ocorre naturalmente em alimentos como iogurte, chucrute e picles.
Outro método envolve síntese química usando acetaldeído como material de partida. O acetaldeído reage com íons cianeto, resultando na formação de lactonitrila. Então ocorre a hidrólise, levando à conversão da lactonitrila em ácido do leite. Este método requer manuseio cuidadoso e controle das condições de reação.
Os cientistas estão produzindo ativamente ácido lácteo por meio de técnicas de bioengenharia, modificando geneticamente bactérias como Escherichia coli. Eles modificam essas bactérias para que expressem enzimas que convertem glicose ou outros açúcares em ácido láctico. Este método permite a produção de ácido lácteo em maior escala e com melhor controle do processo.
O ácido láctico é derivado de recursos renováveis, como milho ou cana-de-açúcar, hidrolisando quimicamente o amido ou a celulose encontrados nesses materiais vegetais em glicose. A ação microbiana ou enzimática fermenta então a glicose em ácido lácteo.
Cada um desses métodos tem suas vantagens e limitações em termos de custo, escalabilidade e impacto ambiental. A escolha do método de síntese depende da aplicação específica e das propriedades desejadas do ácido lácteo.
Usos do ácido láctico
O ácido do leite encontra muitas aplicações em vários setores. Aqui estão alguns usos comuns:
- Indústria de Alimentos e Bebidas: O ácido do leite atua como conservante natural, regulador de acidez e intensificador de sabor em produtos alimentícios como laticínios, produtos de panificação e bebidas. Contribui para o sabor picante do iogurte e confere um sabor amargo ao pão de massa fermentada.
- Indústria farmacêutica: O ácido láctico contribui ativamente para a produção de produtos farmacêuticos, incluindo medicamentos, pomadas e cremes. Serve como ajustador de pH e estabilizador em formulações, melhorando sua eficácia e prazo de validade.
- Cuidados com a pele e cosméticos: O ácido lácteo é um ingrediente chave em produtos para a pele devido às suas propriedades esfoliantes. Ajuda a remover as células mortas da pele, promovendo uma tez mais lisa e brilhante. Cremes e loções anti-envelhecimento usam-no ativamente como ingrediente.
- Indústria Têxtil: Na indústria têxtil, o ácido lácteo participa ativamente do tingimento e regula o pH durante os processos de tingimento e estamparia. Ajuda a melhorar a solidez da cor e a penetração do corante.
- Bioplásticos: O ácido do leite é um precursor para a produção de polímeros biodegradáveis, como o poliácido do leite (PLA). As empresas utilizam amplamente o PLA em materiais de embalagem, talheres descartáveis e outros produtos ecológicos.
- Produtos de limpeza: Os produtos de limpeza utilizam ácido lácteo como um poderoso desinfetante natural e agente descalcificante. Ajuda a remover depósitos minerais e manchas das superfícies, tornando-se uma alternativa ecológica aos produtos químicos agressivos.
- Aplicações industriais: O ácido do leite serve como matéria-prima para a síntese de diversos produtos químicos, incluindo lactatos, solventes e plásticos biodegradáveis.
A natureza versátil do ácido lácteo torna-o um ingrediente valioso em diversas indústrias, contribuindo para o desenvolvimento de produtos sustentáveis e funcionais.
Questões:
P: O que é ácido láctico?
R: O ácido do leite é um composto produzido pelos músculos durante exercícios intensos ou pela fermentação de açúcares por microrganismos, encontrado em alimentos fermentados como o iogurte.
P: Onde ocorre a fermentação do ácido láctico?
R: A fermentação ácida do leite ocorre em uma variedade de organismos, incluindo bactérias, fungos e nossas próprias células musculares.
P: O que é fermentação láctica?
R: A fermentação ácida do leite é um processo metabólico que converte açúcares em ácido láctico, ocorrendo na ausência de oxigênio, resultando na produção de energia.
P: Para que é usado o ácido láctico?
R: O ácido do leite contribui para a fadiga e dores musculares, regula os níveis de acidez no corpo e medeia várias vias bioquímicas.
P: Qual é o uso comercial da fermentação de ácido láctico?
R: A fermentação ácida do leite é usada comercialmente na produção de iogurte, chucrute, picles e outros alimentos fermentados.
P: Como se livrar do ácido láctico?
R: Exercícios leves, hidratação adequada e alongamento podem ajudar a remover e quebrar o ácido láctico dos músculos.
P: Onde é encontrado o ácido láctico?
R: O ácido do leite é encontrado em várias fontes naturais, como laticínios, alimentos fermentados e músculos de animais.
P: Como reduzir o ácido láctico no corpo?
R: Para reduzir o acúmulo de ácido no leite, pode-se incorporar rotinas adequadas de aquecimento e desaquecimento, manter uma dieta balanceada e aumentar gradualmente a intensidade do exercício ao longo do tempo.
