O ácido iodídrico (HI) é um ácido forte formado a partir de hidrogênio e iodo. É utilizado em síntese orgânica e como agente redutor. É muito corrosivo e requer manuseio cuidadoso.
| Nome IUPAC | Ácido iodídrico |
| Fórmula molecular | OI |
| Número CAS | 10034-85-2 |
| Sinônimos | Ácido iodídrico, iodeto de hidrogênio, iodano |
| InChI | InChI=1S/HI/h1H |
Propriedades do ácido iodídrico
Fórmula de ácido iodídrico
A fórmula química do iodeto de hidrogênio é HI. Consiste em um átomo de hidrogênio (H) ligado a um átomo de iodo (I). Esta fórmula simples representa a composição deste ácido forte.
Massa molar do ácido iodídrico
A massa molar do iodeto de hidrogênio (HI) é de aproximadamente 127,91 gramas por mol (g/mol). Este valor é calculado somando as massas atômicas de um átomo de hidrogênio e de um átomo de iodo.
Ponto de ebulição do ácido iodídrico
O iodeto de hidrogênio tem um ponto de ebulição relativamente baixo, em torno de -35 graus Celsius (-31 graus Fahrenheit). A esta temperatura, a forma líquida do HI muda para o estado gasoso.
Ponto de fusão do ácido iodídrico
O ponto de fusão do iodeto de hidrogênio é de aproximadamente -51 graus Celsius (-60 graus Fahrenheit). A esta temperatura, a forma sólida do HI se transforma em estado líquido.
Densidade do ácido iodídrico g/mL
A densidade do iodeto de hidrogênio é de aproximadamente 2,85 gramas por mililitro (g/mL). Esta medição de densidade indica a massa de HI presente em um mililitro da substância.
Peso molecular do ácido iodídrico
O iodeto de hidrogênio tem um peso molecular de aproximadamente 127,91 g/mol. Este valor é a soma dos pesos atômicos do hidrogênio e do iodo na molécula HI.
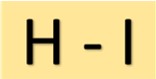
Estrutura do ácido iodídrico
O ácido iodídrico (HI) tem uma estrutura simples. Consiste em um átomo de hidrogênio ligado a um átomo de iodo por uma única ligação covalente. Este arranjo molecular confere ao HI suas propriedades características.
Solubilidade do ácido iodídrico
O ácido iodídrico tem alta solubilidade em água. Quando misturado com água, dissolve-se facilmente formando uma solução incolor. Sua alta solubilidade contribui para seu amplo uso em diversas aplicações, incluindo síntese química.
| Aparência | Líquido incolor |
| Gravidade Específica | 2,85g/ml |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 127,91 g/mol |
| Densidade | 2,85g/ml |
| Ponto de fusão | -51°C (-60°F) |
| Ponto de ebulição | -35°C (-31°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Miscível, formando uma solução incolor |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | -dez |
| pH | Muito ácido (pH <1) |
Segurança e perigos do ácido iodídrico
O iodeto de hidrogênio (HI) apresenta riscos significativos à segurança devido à sua natureza corrosiva. Pode causar queimaduras graves na pele e danos aos olhos por contato. A inalação de seus vapores causa irritação respiratória. Equipamentos de proteção adequados, como luvas e óculos de proteção, devem ser usados ao manusear o HI. Deve ser armazenado em local bem ventilado, longe de substâncias incompatíveis. Em caso de ingestão ou inalação acidental, procure atendimento médico imediatamente. Em caso de derramamento, neutralize com agentes apropriados e descarte como resíduo perigoso. É essencial seguir protocolos rígidos de segurança e manuseá-los com cautela para evitar acidentes e lesões.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Causa queimaduras na pele e lesões oculares graves. Nocivo se inalado. |
| Números de identificação da ONU | UN1787 |
| Código SH | 28111990 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos para a síntese de ácido iodídrico
O iodeto de hidrogênio (HI) pode ser sintetizado por vários métodos. Uma abordagem comum envolve a reação direta do iodo (I2) com o fósforo vermelho (P). Neste método, o I2 é misturado ao fósforo vermelho, que atua como agente redutor. A reação ocorre na presença de água, dando HI e ácido fosfórico.
Outro método envolve a reação do iodo com hidrato de hidrazina (N2H4·H2O). Este processo requer um manuseio cuidadoso devido à natureza potencialmente perigosa do hidrato de hidrazina. A reação resulta na formação de HI e gás nitrogênio.
Alternativamente, a reação do iodo com ácido sulfúrico concentrado (H2SO4) também pode produzir HI. Neste método, o iodo é misturado com ácido sulfúrico concentrado, levando à geração de gás HI, que pode ser coletado e condensado na forma líquida.
É essencial observar que a síntese do iodeto de hidrogênio deve ser realizada com as devidas precauções de segurança. Os produtos químicos envolvidos podem ser perigosos e as reações podem gerar gases tóxicos. Ventilação adequada, equipamento de proteção e adesão às precauções de segurança são cruciais durante o processo de síntese para garantir a produção segura e bem-sucedida de iodeto de hidrogênio.
Usos do ácido iodídrico
O iodeto de hidrogênio (HI) encontra diversas aplicações em diversas indústrias devido às suas propriedades únicas. Aqui estão alguns usos principais:
- Síntese orgânica: A química orgânica usa HI como reagente essencial para converter haletos de alquila em alcanos, um processo conhecido como desalogenação.
- Indústria Farmacêutica: Produção de vários compostos farmacêuticos, incluindo medicamentos contendo iodo e agentes de contraste iodados para imagens médicas, relacionados com HI.
- Agente redutor: O HI funciona ativamente como um poderoso agente redutor em reações químicas, auxiliando na redução de íons metálicos às suas formas elementares.
- Catálise: O HI participa ativamente como catalisador em certas reações químicas, aumentando as taxas de reação e melhorando o rendimento de transformações específicas.
- Limpeza e gravação: As indústrias eletrônicas e de semicondutores usam ativamente o HI para processos de limpeza e gravação devido à sua capacidade de dissolver metais e óxidos metálicos.
- Química analítica: As titulações iodométricas em química analítica usam ativamente o HI para determinar a concentração de certas substâncias com base em sua reação com o iodo.
- Tratamento de Superfícies Metálicas: A HI desempenha ativamente um papel na preparação de superfícies metálicas para galvanização, brasagem e outros processos de tratamento de superfície.
- Fabricação de Iodeto: Várias indústrias usam ativamente o HI para produzir compostos de iodeto para diversas aplicações em áreas como fotografia, medicina e síntese orgânica.
- Reagente de Laboratório: Os laboratórios usam ativamente o HI como um reagente útil para muitas reações químicas e experimentos.
As propriedades versáteis do iodeto de hidrogênio fazem dele uma ferramenta valiosa na pesquisa química, nos processos industriais e no desenvolvimento farmacêutico, contribuindo para avanços em múltiplos setores e descobertas científicas.
Questões:
P: Que composto poderia ser adicionado ao ácido iodídrico (HI) para neutralizar suas propriedades ácidas?
R: Uma base, como hidróxido de sódio (NaOH), pode ser adicionada para neutralizar o iodeto de hidrogênio e formar água e um sal.
P: O ácido iodídrico é um ácido forte?
R: Sim, o iodeto de hidrogênio é um ácido forte, o que significa que ele ioniza completamente na água, liberando íons de hidrogênio.
P: Qual é a fórmula do ácido iodídrico?
R: A fórmula do iodeto de hidrogênio é HI, representando um átomo de hidrogênio ligado a um átomo de iodo.
P: Qual das alternativas a seguir é a fórmula do ácido iodídrico?
R: A fórmula do iodeto de hidrogênio é HI.
P: Quantos mililitros de ácido iodídrico 0,550 M são necessários para reagir com 10,00 ml de CsOH 0,217 M?
A: Aproximadamente 17,58 ml de iodeto de hidrogênio 0,550 M são necessários para reagir com 10,00 ml de CsOH 0,217 M.
P: O ácido iodídrico é ilegal?
R: O iodeto de hidrogénio em si não é ilegal, mas a sua utilização e posse podem ser regulamentadas devido aos seus potenciais perigos e aplicações em atividades ilegais.
P: O que se formam o iodeto de hidrogênio e o sulfeto de magnésio?
R: O iodeto de hidrogênio e o sulfeto de magnésio reagem para formar o gás sulfeto de hidrogênio (H2S) e o sal de iodeto de magnésio (MgI2).
P: O que acontece quando você mistura iodeto de hidrogênio com bicarbonato de sódio?
R: Quando o iodeto de hidrogênio reage com o bicarbonato de sódio (bicarbonato de sódio), produz dióxido de carbono, água e iodeto de sódio.
P: Como funciona o iodeto de hidrogênio na água?
R: O iodeto de hidrogênio ioniza na água, liberando íons hidrogênio (H+) e íons iodeto (I-), resultando em uma solução muito ácida.
P: Equação iônica líquida de hidróxido de sódio e iodeto de hidrogênio?
R: A equação iônica líquida para a reação entre hidróxido de sódio (NaOH) e iodeto de hidrogênio (HI) é Na+ + OH- + H+ + I- → Na+ + I- + H2O.
