O ácido fluoroantimônico é um dos superácidos mais poderosos conhecidos, com uma função de acidez de Hammett de -21. É uma mistura de fluoreto de hidrogênio e pentafluoreto de antimônio.
| Nome IUPAC | Ácido fluoroantimônio (V) |
| Fórmula molecular | H[SbF6] |
| Número CAS | 16950-06-4 |
| Sinônimos | Hexafluoroantimonato de hidrogênio (V), hexafluoreto de antimônio hidratado, fluoreto de hidrogênio de antimônio, ácido fluorídrico com pentafluoroantimônio (1:1) |
| InChI | InChI=1S/F6Sb.H/h1H;/q+1;/p-1 |
pH do ácido fluoroantimônico
O ácido fluoroantimônico é um superácido e tem pH abaixo de -14. Isso ocorre porque a escala de pH mede a concentração de íons hidrogênio (H+) em uma solução e os superácidos têm concentrações mais altas de íons H+ do que a água pura.
Os medidores de pH tradicionais não conseguem medir com precisão o pH do ácido fluoroantimônico porque não foram projetados para lidar com ácidos tão fortes. Em vez disso, os cientistas usam a função de acidez de Hammett para medir a acidez do ácido fluoroantimônico. A função de acidez de Hammett compara a acidez dos superácidos usando o grau de protonação de um composto de referência. O ácido fluoroantimônico tem uma função de acidez de Hammett de -21, que é o valor mais negativo possível e indica que é um dos superácidos mais poderosos conhecidos.
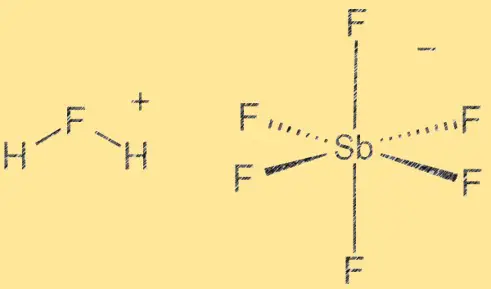
Estrutura do ácido fluoroantimônico:
O ácido fluoroantimônico tem uma estrutura molecular que consiste em um íon hidrogênio (H+) e um íon hexafluoroantimonato (V) ([SbF6]^-). O íon SbF6 atua como um ácido de Lewis, enquanto o íon H+ atua como um ácido de Bronsted. O composto é altamente polar devido à diferença de eletronegatividade entre os átomos de hidrogênio e flúor. A ligação entre o antimônio e o flúor é covalente, enquanto a ligação entre o hidrogênio e o flúor é covalente polar.
Massa molar do ácido fluoroantimônico:
O ácido fluoroantimônico tem massa molar de 216,74 g/mol. É um superácido altamente reativo e corrosivo composto de fluoreto de hidrogênio (HF) e pentafluoreto de antimônio (SbF5). A elevada massa molar do ácido fluoroantimônico pode ser atribuída à presença do átomo pesado de antimônio em sua estrutura molecular.
Ponto de ebulição do ácido fluoroantimônico:
O HSbF6 é um composto altamente reativo e instável e, portanto, não possui ponto de ebulição definido. Ele se decompõe em temperaturas acima de -10°C, liberando vapores tóxicos de gás fluoreto de hidrogênio. Seu ponto de ebulição é estimado em torno de 20-30°C, mas este não é um parâmetro útil para descrever as propriedades do HSbF6.
Ponto de fusão do ácido fluoroantimônico:
O HSbF6 não possui um ponto de fusão bem definido devido à sua natureza altamente reativa. Ele só pode existir no estado líquido e se decompõe rapidamente ao ser resfriado a temperaturas mais baixas. Estima-se que ele se decomponha em torno de -90°C, liberando vapores tóxicos de fluoreto de hidrogênio e pentafluoreto de antimônio.
Densidade do ácido fluoroantimônico g/ml:
A densidade do HSbF6 é 2,1 g/mL. Essa alta densidade pode ser atribuída à presença de átomos pesados de antimônio em sua estrutura molecular. É um composto altamente corrosivo e reativo e deve ser manuseado com extremo cuidado. A densidade do HSbF6 também dificulta seu manuseio em laboratório.
Peso molecular do ácido fluoroantimônico:
O peso molecular do ácido fluoroantimônico é 236,76 g/mol. É composto por um íon hidrogênio, um íon antimônio e seis íons fluoreto. O alto peso molecular do ácido fluoroantimônico pode ser atribuído à presença do átomo pesado de antimônio em sua estrutura molecular.
Fórmula de ácido fluoroantimônico:
A fórmula química do ácido fluoroantimônico é H[SbF6]. É composto por um íon hidrogênio (H+) e um íon hexafluoroantimonato (V) ([SbF6]^-). O íon [SbF6]^- é formado pela reação do pentafluoreto de antimônio (SbF5) com fluoreto de hidrogênio (HF). A fórmula representa a proporção de números inteiros mais simples dos átomos presentes no composto.
| Aparência | Líquido incolor a amarelo pálido |
| Gravidade Específica | 2,1 g/ml |
| Cor | Incolor a amarelo pálido |
| Cheiro | Inodoro |
| Massa molar | 236,76 g/mol |
| Densidade | 2,1 g/ml |
| Ponto de fusão | Decompõe-se em torno de -90°C |
| Ponto de ebulição | Decompõe-se acima de -10°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage violentamente com água |
| Solubilidade | Solúvel em HF anidro, SbF5, SO2F2 e SO2ClF |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | -21 (função de acidez de Hammett) |
| pH | Menos de -14 |
Nota: O ácido fluoroantimônico é um composto altamente reativo e corrosivo que deve ser manuseado com extremo cuidado. Suas propriedades físicas e químicas são difíceis de medir com precisão devido à sua natureza instável e aos métodos limitados disponíveis para sua manipulação. Os valores listados nesta tabela são estimativas baseadas na literatura disponível e podem não ser precisos.
Segurança e perigos do ácido fluoroantimônico
O ácido fluoroantimônico é uma substância extremamente perigosa e altamente corrosiva que apresenta riscos significativos à saúde e à segurança. É um poderoso agente oxidante que pode reagir violentamente com água, compostos orgânicos e até alguns metais. Pode causar queimaduras graves e danos nos tecidos em contacto com a pele ou os olhos, e a inalação dos seus vapores pode causar dificuldade respiratória e danos nos pulmões.
Pessoal treinado deve manusear o ácido fluoroantimônico utilizando equipamento especializado e roupas de proteção em laboratórios bem ventilados e devidamente equipados. As agências reguladoras regulam e limitam estritamente o uso do ácido fluoroantimônico devido ao seu potencial de causar lesões graves e danos ambientais.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Não respire os vapores. Use luvas, roupas e proteção para os olhos/face. Evite contato com a pele, olhos e roupas. Use apenas sob uma capa química. |
| Números de identificação da ONU | UN3264 |
| Código SH | 28111990 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | III |
| Toxicidade | Muito tóxico e corrosivo; pode causar queimaduras graves e danos nos tecidos em contacto com a pele ou os olhos, e a inalação dos seus vapores pode causar dificuldade respiratória e danos nos pulmões. |
Métodos para a síntese de ácido fluoroantimônico
O ácido fluoroantimônico (HSbF6) é geralmente sintetizado pela mistura de fluoreto de hidrogênio (HF) e pentafluoreto de antimônio (SbF5) em uma proporção molar de 1:1. A reação ocorre sob condições anidras e a baixas temperaturas para evitar a decomposição do superácido resultante. A reação global pode ser representada da seguinte forma:
HF + SbF5 → HSbF6
A reação é altamente exotérmica e pode liberar uma grande quantidade de calor. Portanto, geralmente é realizado em ambiente bem ventilado e controlado, como uma capela química, utilizando medidas de proteção adequadas.
Para preparar HSbF6, o trifluoreto de antimônio (SbF3) pode reagir com HF na presença de um agente oxidante como SbF5 ou difluoreto de dióxido de enxofre (SO2F2). Esta reação requer condições anidras e baixas temperaturas. A reação pode ser expressa da seguinte forma:
SbF3 + 3HF + SO2F2 → HSbF6 + SO2
O HSbF6 é um composto altamente reativo e instável que requer manuseio e armazenamento especiais. Geralmente é armazenado em recipientes selados e herméticos, sob condições anidras e em baixas temperaturas para evitar a decomposição. Medidas de segurança e equipamentos de proteção adequados são essenciais ao trabalhar com HSbF6 devido à sua alta toxicidade e corrosividade.
Usos do ácido fluoroantimônico
O ácido fluoroantimônico (HSbF6) é um dos superácidos conhecidos mais potentes e tem uma ampla gama de aplicações industriais e de pesquisa. Aqui estão alguns dos usos do ácido fluoroantimônico:
- HSbF6 serve como catalisador em várias reações químicas, incluindo alquilações, isomerizações e polimerizações.
- A indústria petroquímica utiliza HSbF6 na produção de gasolina de alta octanagem e outros hidrocarbonetos.
- Pesquisadores da indústria farmacêutica utilizam o HSbF6 como catalisador na síntese de diversos produtos farmacêuticos, incluindo medicamentos antivirais e anticancerígenos.
- O HSbF6 tem aplicação na gravação e limpeza de componentes eletrônicos, como microchips e semicondutores, utilizados na produção de componentes eletrônicos.
- Os cientistas usam o HSbF6 como ferramenta de pesquisa em diversas áreas da química e da ciência dos materiais, incluindo a síntese de novos materiais e o estudo de reações químicas.
O HSbF6 é uma substância altamente reativa e perigosa que requer manuseio especializado e medidas de proteção. É estritamente regulamentado e só deve ser utilizado por pessoal treinado em laboratórios bem equipados. Os perigos potenciais associados ao HSbF6 limitam a sua utilização a aplicações especializadas para as quais não existem outras alternativas disponíveis.
Questões:
O ácido fluoroantimônico pode dissolver o diamante?
O HSbF6 pode dissolver o diamante devido às suas fortes propriedades ácidas. Profissionais treinados em laboratórios bem equipados, com medidas de segurança e equipamentos de proteção adequados, podem realizar a reação muito perigosa entre o diamante e o HSbF6. No entanto, não é um método prático ou econômico para processamento ou corte de diamantes. O corte mecânico ou o corte a laser são muito mais utilizados devido à sua eficiência e segurança.
Onde comprar ácido fluoroantimônico?
Comprar HSbF6 é extremamente difícil devido à sua natureza altamente perigosa e regulamentada. Somente empresas ou instituições aprovadas e autorizadas com as licenças e equipamentos necessários podem manusear e armazenar ácido com segurança.
A Convenção sobre Armas Químicas (CWC) e os regulamentos dos Padrões Antiterrorismo para Instalações Químicas dos EUA (CFATS) classificam o HSbF6 como uma substância perigosa e controlada.
Agências governamentais como a Agência de Proteção Ambiental (EPA), o Departamento de Segurança Interna (DHS) e o Departamento de Indústria e Segurança (BIS) regulam e controlam estritamente a venda e compra de HSbF6.
Se você tiver uma necessidade legítima de HSbF6, poderá entrar em contato com fornecedores de produtos químicos aprovados ou institutos de pesquisa com as licenças e conhecimentos necessários.
No entanto, você deve fornecer uma justificativa detalhada e obter as aprovações e autorizações necessárias antes de fazer qualquer compra.
