O ácido clorossulfônico é um ácido forte com a fórmula HSO₃Cl. É muito corrosivo, utilizado como reagente em síntese orgânica e como agente sulfonante na fabricação de detergentes e corantes.
| Nome da IUPAC | Ácido clorossulfônico |
| Fórmula molecular | HSO₃Cl |
| Número CAS | 7790-94-5 |
| Sinônimos | Cloridrina sulfúrica, ácido clorossulfúrico, ácido clorossulfônico |
| InChI | InChI=1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
Propriedades do ácido clorossulfônico
Fórmula de ácido clorossulfônico
A fórmula do ácido clorossulfônico é HSO₃Cl. Consiste em um átomo de hidrogênio, um átomo de enxofre, três átomos de oxigênio e um átomo de cloro.
Massa molar do ácido clorossulfônico
A massa molar do ácido clorossulfúrico é calculada somando as massas atômicas de seus átomos constituintes. A massa molar de HSO₃Cl é aproximadamente 116,5 gramas por mol.
Ponto de ebulição do ácido clorossulfônico
O ponto de ebulição do ácido clorossulfúrico é relativamente alto. Está em torno de 151 graus Celsius (304 graus Fahrenheit). A esta temperatura, o ácido clorossulfúrico muda de uma fase líquida para uma fase gasosa.
Ponto de fusão do ácido clorossulfônico
O ácido clorossulfúrico tem um ponto de fusão em torno de -82 graus Celsius (-116 graus Fahrenheit). Esta é a temperatura na qual a forma sólida do ácido clorossulfúrico se transforma em líquido.
Densidade do ácido clorossulfônico g/mL
O ácido clorossulfúrico tem uma densidade de aproximadamente 1,75 gramas por mililitro (g/mL) à temperatura ambiente. Isto significa que um determinado volume de ácido clorossulfúrico é relativamente pesado comparado a um volume igual de água.
Peso molecular do ácido clorossulfônico
O peso molecular do ácido clorossulfúrico é calculado somando os pesos atômicos de todos os átomos de sua fórmula química. O ácido clorossulfúrico tem um peso molecular de aproximadamente 116,5 gramas por mol.
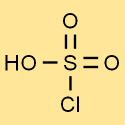
Estrutura do ácido clorossulfônico
A estrutura do ácido clorossulfúrico consiste em um átomo de enxofre ligado a três átomos de oxigênio e um átomo de cloro. O átomo de hidrogênio está ligado a um dos átomos de oxigênio. Esta estrutura confere ao ácido clorossulfúrico suas propriedades e reatividade únicas.
Solubilidade do ácido clorossulfônico
O ácido clorossulfúrico é muito solúvel em água. Dissolve-se facilmente em água, formando uma solução fortemente ácida. A solubilidade do ácido clorossulfúrico se deve à sua natureza polar e à formação de ligações de hidrogênio com moléculas de água.
| Aparência | Líquido incolor a amarelo |
| Gravidade Específica | 1,75 (a 20°C) |
| Cor | Incolor a amarelo |
| Cheiro | Odor forte e pungente |
| Massa molar | 116,5 g/mol |
| Densidade | 1,75 g/mL (a 20°C) |
| Ponto de fusão | -82°C (-116°F) |
| Ponto de ebulição | 151°C (304°F) |
| Ponto flash | Não disponível |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel em solventes orgânicos como clorofórmio, diclorometano, nitrobenzeno |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | -2,6 |
| pH | Muito ácido (pH <1) |
Nota: Tenha em mente que os valores fornecidos nesta tabela são propriedades gerais associadas ao ácido clorossulfúrico. Os valores reais podem variar ligeiramente dependendo das condições específicas e da pureza do composto.
Segurança e perigos do ácido clorossulfônico
O ácido clorossulfúrico apresenta riscos de segurança significativos e deve ser manuseado com extremo cuidado. É muito corrosivo e pode causar queimaduras graves em contato com a pele, os olhos e o aparelho respiratório. A inalação ou ingestão pode causar sérios riscos à saúde, incluindo dificuldade respiratória e danos aos órgãos internos. Reage violentamente com a água, liberando gases tóxicos e gerando calor. Existem riscos de incêndio e explosão em contato com materiais orgânicos. Equipamentos de proteção individual adequados, como luvas, óculos de proteção e respirador, devem ser usados ao trabalhar com ácido clorossulfúrico. Medidas adequadas de ventilação e contenção são cruciais para minimizar a exposição e garantir a segurança no manuseio desta substância perigosa.
| Símbolos de perigo | Corrosivo (C), Nocivo (Xn) |
| Descrição de segurança | – Manuseie com extremo cuidado\n- Use equipamento de proteção adequado\n- Evite contato com a pele, olhos e inalação\n- Armazene em área bem ventilada\n- Não misture com água ou substâncias reativas |
| Números de identificação da ONU | ONU 1751 |
| Código SH | 28121100 |
| Classe de perigo | Classe 8 – Substâncias corrosivas |
| Grupo de embalagem | Grupo de embalagem II |
| Toxicidade | Muito tóxico; causa queimaduras graves e danos respiratórios |
Métodos para a síntese de ácido clorossulfônico
Existem vários métodos para sintetizar o ácido clorossulfúrico. Um método comum envolve a reação entre trióxido de enxofre (SO₃) e cloreto de hidrogênio (HCl) . Neste processo, a solução de HCl é borbulhada com gás SO₃ para gerar ácido clorossulfúrico. É necessário um controle cuidadoso da temperatura e das condições de reação devido à alta exotermicidade da reação.
Em outro método, a reação do gás cloro (Cl₂) com ácido sulfúrico (H₂SO4) produz ácido clorossulfúrico. A passagem do gás cloro através do ácido sulfúrico concentrado resulta na formação de ácido clorossulfúrico. Para garantir a segurança, você deve tomar medidas adequadas contra esta reação exotérmica.
Além disso, a preparação do ácido clorossulfúrico envolve a reação do ácido sulfúrico com cloreto de sulfurila (SO₂Cl₂). O cloreto de sulfurila reage com o ácido sulfúrico para formar ácido clorossulfúrico e gás cloreto de hidrogênio.
Ressalta-se que a síntese do ácido clorossulfúrico deve ser realizada em laboratório bem equipado, seguindo protocolos de segurança adequados. O químico deve utilizar equipamentos de proteção, como luvas, óculos e capuz, para garantir sua segurança.
Esses métodos de síntese permitem que os químicos produzam ácido clorossulfúrico, um composto versátil usado em diversas aplicações industriais, incluindo síntese orgânica, reações de sulfonação e produção de corantes e detergentes.
Usos do ácido clorossulfônico
O ácido clorossulfúrico encontra amplas aplicações em diversas indústrias devido às suas propriedades versáteis. Aqui estão alguns de seus usos:
- O ácido clorossulfúrico participa ativamente de diversas reações de síntese orgânica, incluindo esterificações, sulfonações e halogenações, servindo como um potente reagente. Introduz eficientemente grupos funcionais e modifica estruturas moleculares.
- Na fabricação de corantes, o ácido clorossulfúrico desempenha um papel crucial porque sulfona ativamente compostos aromáticos, permitindo a criação de grupos de ácido sulfônico. Esses grupos melhoram a solubilidade dos corantes e melhoram as propriedades da cor.
- Na produção de detergentes, o ácido clorossulfúrico funciona ativamente como agente sulfonante durante a síntese de compostos detergentes. Contribui ativamente para a formação de surfactantes, melhorando as suas propriedades de limpeza e formação de espuma.
- A indústria farmacêutica utiliza amplamente o ácido clorossulfúrico como componente ativo em pesquisa e fabricação. Introduz ativamente grupos sulfonamidas nas moléculas dos medicamentos, o que tem um impacto significativo nas suas propriedades farmacológicas.
- As reações de polimerização utilizam ativamente o ácido clorossulfúrico como catalisadores ou iniciadores para a síntese de polímeros especiais. Esses polímeros estão encontrando ativamente aplicações em diversas indústrias, como revestimentos, adesivos e isolamento elétrico.
- Serve como um intermediário importante na produção de vários produtos químicos, incluindo ácidos sulfônicos, ésteres de ácido sulfúrico e clorossulfonatos. Esses compostos encontram aplicações em diversas indústrias, como farmacêutica, agroquímica e fabricação de polímeros.
- No laboratório, os pesquisadores usam ativamente o ácido clorossulfúrico como reagente para diversas reações químicas, como reações de esterificação, acilação e desidratação.
É importante manusear o ácido clorossulfúrico com cautela devido à sua natureza corrosiva e aos potenciais riscos à saúde.
Questões:
P: Como faço para criar cloreto de acetamidobenzenossulfonil a partir de acetanilida e ácido clorossulfônico?
R: O cloreto de acetamidobenzenossulfonil é formado pelo tratamento da acetanilida com ácido clorossulfúrico, resultando na substituição do grupo amino pelo grupo cloreto de sulfonil.
P: Como usar o ácido clorossulfônico?
R: O ácido clorossulfúrico é utilizado como reagente em diversas reações químicas, como sulfonação, esterificação e acilação, para introduzir grupos funcionais ou modificar estruturas moleculares.
P: O ácido clorossulfônico é um bom grupo de saída?
R: Sim, o ácido clorossulfúrico é um bom grupo de saída devido à estabilidade do grupo ácido sulfônico e à sua capacidade de sofrer reações de substituição.
P: Como remover o ácido clorossulfônico?
R: O ácido clorossulfúrico deve ser neutralizado com uma base, como carbonato de sódio, depois diluído com água e descartado cuidadosamente de acordo com as regulamentações locais.
P: O que acontece quando o ácido clorossulfônico entra em contato com a água?
R: Quando o ácido clorossulfúrico entra em contato com a água, ele reage vigorosamente, liberando calor e gases tóxicos, como dióxido de enxofre e cloreto de hidrogênio.
P: O lauril sulfato de sódio pode ser preparado substituindo o ácido clorossulfônico por outro reagente?
R: Sim, o lauril sulfato de sódio pode ser sintetizado substituindo o ácido clorossulfúrico por ácido sulfúrico na reação com álcool laurílico, seguido de neutralização com hidróxido de sódio.
P: Qual é a densidade do ácido clorossulfônico?
R: A densidade do ácido clorossulfúrico é de aproximadamente 1,75 g/mL à temperatura ambiente.
P: Quantos moles de ácido clorossulfônico são necessários para produzir um mol de cloreto de acetamidobenzenossulfonil?
R: Um mol de cloreto de acetamidobenzenossulfonil pode ser obtido pela reação de um mol de acetanilida com um mol de ácido clorossulfúrico.
P: O ácido clorossulfônico pode ser armazenado com oxidantes?
R: Não, o ácido clorossulfúrico deve ser armazenado separadamente dos oxidantes, pois pode reagir violentamente ou aumentar o risco de incêndio quando em contato com substâncias oxidantes.
