O ácido cloroacético é um composto químico com a fórmula CH₂ClCOOH. É utilizado em diversas aplicações industriais, incluindo a produção de corantes, produtos farmacêuticos e herbicidas.
| Nome IUPAC | Ácido cloroacético |
| Fórmula molecular | CH₂ClCOOH |
| Número CAS | 79-11-8 |
| Sinônimos | Ácido monocloroacético, MCA, ácido cloroetanóico, ácido cloroetílico |
| InChI | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
Propriedades do ácido cloroacético
Fórmula de Ácido Cloroacético
A fórmula do ácido cloroacético é CH₂ClCOOH. Consiste em dois átomos de carbono, três átomos de hidrogênio, um átomo de cloro e dois átomos de oxigênio. O átomo de cloro está ligado a um dos átomos de carbono, enquanto o outro átomo de carbono está ligado ao grupo ácido carboxílico (-COOH).
Massa molar do ácido cloroacético
A massa molar do ácido monocloroacético é calculada somando as massas atômicas de seus elementos constituintes. O ácido monocloroacético tem uma massa molar de aproximadamente 94,5 gramas por mol. É determinado considerando as massas atômicas de carbono (C), hidrogênio (H), cloro (Cl) e oxigênio (O) presentes no composto.
Ponto de ebulição do ácido cloroacético
O ácido monocloroacético tem um ponto de ebulição em torno de 189 graus Celsius. A esta temperatura, o ácido monocloroacético líquido se transforma na fase gasosa. O ponto de ebulição do ácido monocloroacético é influenciado pelas forças intermoleculares entre suas moléculas e pela pressão atmosférica.
Ponto de fusão do ácido cloroacético
O ponto de fusão do ácido monocloroacético é de cerca de 62 graus Celsius. Esta é a temperatura na qual a forma sólida do ácido monocloroacético muda para o estado líquido. O ponto de fusão pode variar ligeiramente dependendo da pureza da amostra e das condições sob as quais ela é medida.
Densidade do ácido cloroacético g/mL
A densidade do ácido monocloroacético é de aproximadamente 1,58 gramas por mililitro. Indica a massa de ácido monocloroacético por unidade de volume. A densidade do ácido monocloroacético é influenciada por fatores como temperatura e pressão.
Peso molecular do ácido cloroacético
O peso molecular do ácido monocloroacético é de aproximadamente 94,5 gramas por mol. Representa a soma dos pesos atômicos de todos os átomos de uma molécula de ácido monocloroacético. O peso molecular é útil em vários cálculos envolvendo o composto, como na determinação de concentrações ou quantidades molares.
Estrutura do ácido cloroacético
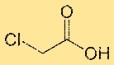
O ácido monocloroacético tem uma estrutura que consiste em um átomo de carbono central ligado a um átomo de cloro, um grupo ácido carboxílico (-COOH) e dois átomos de hidrogênio. O átomo de cloro está diretamente ligado ao átomo de carbono. O arranjo estrutural do ácido monocloroacético influencia suas propriedades químicas e reatividade.
Solubilidade do ácido cloroacético
O ácido monocloroacético é moderadamente solúvel em água. Forma ligações de hidrogênio com moléculas de água, permitindo que ela se dissolva até certo ponto. A solubilidade do ácido monocloroacético é influenciada por fatores como temperatura, pH e presença de outras substâncias na solução.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,58g/ml |
| Cor | Incolor |
| Cheiro | Vinagre |
| Massa molar | 94,5 g/mol |
| Densidade | 1,58g/ml |
| Ponto de fusão | 62°C |
| Ponto de ebulição | 189ºC |
| Ponto flash | 111°C |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel em etanol, éter, clorofórmio |
| Pressão de vapor | 0,23 mmHg a 25°C |
| Densidade do vapor | 3,3 (ar = 1) |
| pKa | 2,87 |
| pH | 1,5 – 2,5 |
Segurança e perigos do ácido cloroacético
O ácido monocloroacético apresenta vários riscos de segurança e deve ser manuseado com cautela. É corrosivo para a pele, olhos e aparelho respiratório, causando queimaduras e irritação. O contato direto pode causar sérios danos à pele e aos olhos. A inalação de seus vapores ou névoas pode irritar o trato respiratório. Também é prejudicial se ingerido, causando distúrbios gastrointestinais. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao trabalhar com ácido monocloroacético. A ventilação adequada é crucial para minimizar a exposição. Em caso de contato com a pele ou olhos, é imprescindível enxaguar imediatamente com água e procurar atendimento médico.
| Símbolos de perigo | Corrosivo, Tóxico |
| Descrição de segurança | Evite contato. Use equipamento de proteção individual. Garanta ventilação adequada. Manuseie com cuidado. |
| Números de identificação da ONU | ONU 1751 |
| Código SH | 2915.12.00 |
| Classe de perigo | 8 (Corrosivo) |
| Grupo de embalagem | II |
| Toxicidade | Tóxico por ingestão, inalação e absorção pela pele. Causa queimaduras graves e lesões oculares. Perigoso se ingerido. |
Métodos para a síntese de ácido cloroacético
Vários métodos permitem a síntese de ácido monocloroacético.
Um método comumente usado para sintetizar ácido monocloroacético envolve o tratamento do ácido acético com um agente halogenante, geralmente cloro gasoso (Cl2), na presença de um catalisador tal como ácido sulfúrico (H2SO4). A reação entre o ácido acético e o cloro resulta na substituição de um átomo de hidrogênio na molécula de ácido acético por um átomo de cloro, formando assim o ácido monocloroacético.
Outro método envolve a reação entre cloreto de acetila (CH₃COCl) e água (H₂O). A água hidrolisa o cloreto de acetila, levando à formação de ácido monocloroacético. Esta reação é exotérmica e requer cautela na sua realização.
A formação do ácido monocloroacético ocorre através da carboxilação do clorometano (CH₃Cl) utilizando dióxido de carbono (CO₂) na presença de uma base robusta como o hidróxido de sódio (NaOH) . A reação prossegue por substituição nucleofílica, onde o grupo carboxilato (-COOH) da molécula de dióxido de carbono substitui o íon cloreto.
Lembre-se que o manuseio adequado e as precauções de segurança são cruciais para estes métodos de síntese devido à natureza corrosiva e tóxica do ácido monocloroacético. Garanta o controle cuidadoso das condições de reação e o descarte adequado de subprodutos e resíduos para garantir processos de síntese seguros e eficientes.
Usos do ácido cloroacético
O ácido monocloroacético encontra aplicações em diversas indústrias devido às suas propriedades versáteis. Aqui estão alguns usos comuns:
- Produção de herbicidas: O ácido monocloroacético é um ingrediente essencial na síntese de herbicidas, como o glifosato. Ajuda a inibir o crescimento de plantas e ervas daninhas indesejadas na agricultura.
- Fabricação Farmacêutica: Serve como alicerce na produção de compostos farmacêuticos, incluindo antibióticos, anti-sépticos e analgésicos. O ácido monocloroacético ajuda a modificar e melhorar as propriedades desejadas desses medicamentos.
- Indústria de Corantes e Pigmentos: Os fabricantes utilizam ácido monocloroacético na produção de corantes e pigmentos. Auxilia na síntese de corantes utilizados em têxteis, tintas, tintas e outras aplicações decorativas.
- Intermediários Químicos: Atua como um composto intermediário chave na produção de vários produtos químicos. A síntese de polímeros, solventes, plastificantes e outros compostos orgânicos envolve a utilização destes intermediários.
- Fabricação de surfactantes: O ácido monocloroacético desempenha um papel na produção de surfactantes, que são componentes essenciais de detergentes, agentes de limpeza e produtos de higiene pessoal. Os surfactantes ajudam a reduzir a tensão superficial entre os líquidos, permitindo melhores capacidades de mistura e dispersão.
- Aplicações em Pesquisa e Laboratório: Laboratórios de pesquisa utilizam ácido monocloroacético como reagente para reações químicas, particularmente em síntese orgânica e procedimentos analíticos.
- Reações Químicas e Síntese Orgânica: Serve como importante reagente em diversas reações orgânicas, como substituições nucleofílicas, esterificações e reações de carboxilação.
- Galvanoplastia: O ácido monocloroacético encontra aplicação em processos de galvanoplastia, onde atua como fonte de cloro para a deposição de revestimentos metálicos em superfícies.
Estas diversas aplicações destacam a importância do ácido monocloroacético em todas as indústrias, contribuindo para o desenvolvimento de numerosos produtos e processos químicos.
Questões:
P: Qual é o valor Ka para uma solução 0,15 M de ácido cloroacético com pH de 1,86?
R: O valor Ka do ácido monocloroacético pode ser calculado usando o valor do pH e é aproximadamente 1,4 x 10^-3.
P: O ácido cloroacético é forte ou fraco?
R: O ácido monocloroacético é um ácido fraco.
P: O que o 4-clorofenolato de sódio + ácido cloroacético fornece?
R: A reação do 4-clorofenolato de sódio com ácido monocloroacético dá ácido 4-clorofenoxiacético e cloreto de sódio.
P: Qual é o Ka do ácido cloroacético?
R: O valor Ka do ácido monocloroacético é aproximadamente 1,4 x 10^-3.
P: O ácido cloroacético é monoprótico?
R: Sim, o ácido monocloroacético é monoprótico, o que significa que só pode ceder um próton (íon H+) em uma reação química.
P: Qual é a constante de ionização do ácido cloroacético?
R: A constante de ionização (Ka) do ácido monocloroacético é aproximadamente 1,4 x 10^-3.
P: O ácido cloroacético é mais forte do que o ácido acético?
R: Sim, o ácido monocloroacético é mais forte que o ácido acético.
P: Por que o ácido cloroacético é mais forte que o ácido acético?
R: A presença do átomo de cloro no ácido monocloroacético aumenta sua capacidade de atração de elétrons, tornando-o mais ácido que o ácido acético.
P: Qual é a massa molar do ácido cloroacético?
R: A massa molar do ácido monocloroacético é de aproximadamente 94,5 gramas por mol.
