O ácido clórico (HClO3) é um ácido forte e instável que pode ser produzido pela mistura de dióxido de cloro com água. É utilizado em agentes de branqueamento e desinfecção, bem como na produção de explosivos.
| Nome IUPAC | Ácido clórico |
| Fórmula molecular | HClO3 |
| Número CAS | 7790-93-4 |
| Sinônimos | Ácido perclórico, clorato; Solução de ácido clórico; Ácido clórico (V); Clorato de hidrogênio; Triclorato de hidrogênio |
| InChI | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
As propriedades do ácido clorídrico (HClO3) são de particular interesse para químicos e engenheiros devido às suas muitas aplicações industriais.
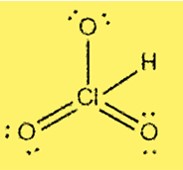
Estrutura de Lewis HClO3
A estrutura de Lewis do HClO3 mostra que o cloro é o átomo central ligado a três átomos de oxigênio e um átomo de hidrogênio. O cloro possui 7 elétrons de valência e cada oxigênio possui 6 elétrons de valência. A estrutura inclui três ligações simples e uma ligação dupla entre átomos de cloro e oxigênio.
Fórmula de ácido clórico (HClO3)
A fórmula química do ácido clórico (HClO3) é HClO3. É um ácido inorgânico que contém um átomo de cloro, um átomo de hidrogênio e três átomos de oxigênio. A fórmula do ácido clorídrico (HClO3) é usada para calcular a estequiometria e a concentração das soluções que contêm o ácido.
Massa molar de ácido clórico (HClO3)
A massa molar do ácido clórico (HClO3) é 84,46 g/mol. É um ácido relativamente leve em comparação com outros ácidos inorgânicos, como o ácido sulfúrico, que possui massa molar de 98,08 g/mol. A massa molar do ácido clórico (HClO3) é um parâmetro importante no cálculo da concentração e estequiometria de soluções contendo o ácido.
Ponto de ebulição do ácido clórico (HClO3)
O ácido clórico (HClO3) tem um ponto de ebulição de 40,5°C. É um ácido muito volátil que pode se decompor em altas temperaturas, dificultando seu manuseio e armazenamento. O baixo ponto de ebulição do ácido clórico (HClO3) é uma consideração importante no projeto de equipamentos e processos que envolvem o uso do ácido.
Ponto de fusão do ácido clorídrico (HClO3)
O ácido clórico (HClO3) não possui ponto de fusão bem definido. Pode se decompor antes de atingir seu ponto de fusão, liberando gás oxigênio e deixando um resíduo de cloratos. A falta de um ponto de fusão distinto se deve à instabilidade do ácido clorídrico (HClO3).
Densidade do ácido clórico (HClO3) g/ml
A densidade do ácido clorídrico (HClO3) é 1,97 g/cm³. É um ácido relativamente denso se comparado a outros ácidos inorgânicos, como o ácido clorídrico, que possui densidade de 1,18 g/cm³. A alta densidade do ácido clórico (HClO3) é uma consideração importante no projeto de processos que envolvem o manuseio e transporte de ácido.
Peso molecular do ácido clorídrico (HClO3)
O peso molecular do ácido clórico (HClO3) é 84,46 g/mol. É a soma dos pesos atômicos dos seus elementos constituintes: um átomo de cloro, um átomo de hidrogênio e três átomos de oxigênio. O peso molecular do ácido clórico (HClO3) é um parâmetro importante no cálculo da concentração e estequiometria de soluções contendo o ácido.
Estrutura do ácido clorídrico (HClO3)
A estrutura do ácido clórico é composta por um átomo central de cloro ligado a três átomos de oxigênio e um átomo de hidrogênio. A molécula tem geometria tetraédrica, com o átomo de cloro no centro do tetraedro. Os três átomos de oxigênio estão dispostos em torno do átomo de cloro em um arranjo trigonal planar, enquanto o átomo de hidrogênio está ligado a um dos átomos de oxigênio. A estrutura do ácido clorídrico (HClO3) é importante para a compreensão de suas propriedades químicas e reatividade.
| Aparência | Líquido transparente ou amarelado |
| Gravidade Específica | 1,97 |
| Cor | Incolor a amarelo |
| Cheiro | Inodoro |
| Massa molar | 84,46 g/mol |
| Densidade | 1,68g/cm³ |
| Ponto de fusão | Decompõe-se antes de derreter |
| Ponto de ebulição | 40,5°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Miscível |
| Solubilidade | Solúvel na maioria dos solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | -0,6 |
| PH | <1 |
Ácido clórico (HClO3) Segurança e perigos
O ácido clórico (HClO3) apresenta vários riscos de segurança e deve ser manuseado com cuidado. É um oxidante forte que pode reagir violentamente com muitos materiais orgânicos, incluindo combustíveis, agentes redutores e líquidos inflamáveis. Pode causar queimaduras graves na pele e nos olhos em contato e pode ser corrosivo para superfícies metálicas. A inalação dos seus vapores pode causar irritação respiratória e tosse. Devido à sua natureza reativa, deve ser armazenado e manuseado em área bem ventilada, longe de outros produtos químicos. Equipamentos de proteção, como luvas, óculos de proteção e respirador, devem ser usados ao manusear ácido clorídrico para evitar exposição. Em caso de contato com a pele ou com os olhos, deve-se procurar atendimento médico imediato.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Evitar o contato com a pele e os olhos; usar equipamento de proteção |
| Identificadores AN | ONU 3084 |
| Código SH | 2811.19 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Corrosivo; pode causar queimaduras graves na pele e nos olhos |
Métodos para a síntese de ácido clorídrico (HClO3)
O ácido clórico pode ser sintetizado por vários métodos, incluindo a reação do cloro gasoso com hidróxido de sódio ou clorato de sódio. Um método comum é a reação do clorato de sódio com ácido clorídrico.
A reação de síntese do ácido clorídrico envolve a reação do clorato de sódio (NaClO3) com ácido clorídrico (HCl) em um processo de duas etapas. A primeira etapa envolve a conversão de clorato de sódio em clorito de sódio (NaClO2) e dióxido de cloro (ClO2) gasoso na presença de um catalisador ácido. Na segunda etapa, o dióxido de cloro gasoso reage com o excesso de ácido clorídrico para formar ácido clórico e cloro gasoso.
Outro método de síntese de ácido clórico envolve a eletrólise de uma solução contendo cloreto de sódio, ácido nítrico e ácido sulfúrico. Este processo produz cloro gasoso que reage com a água para formar ácido clórico.
Para produzir ácido clórico, o clorato de potássio pode reagir com ácido sulfúrico e depois a mistura obtida é destilada.
A síntese do ácido clorídrico requer um manuseio cuidadoso dos reagentes devido ao risco de reações violentas e à natureza corrosiva dos ácidos envolvidos. É importante seguir os protocolos de segurança adequados e manusear os materiais em uma área bem ventilada, usando equipamento de proteção adequado.
Usos do ácido clorídrico (HClO3)
O ácido clórico (HClO3) tem diversas aplicações em diversas indústrias devido às suas fortes propriedades oxidantes. Alguns de seus usos são:
- Produção de outros produtos químicos: O ácido clórico serve como intermediário na produção de outros produtos químicos, incluindo ácido perclórico, cloratos e percloratos.
- Agente de branqueamento: A indústria de celulose e papel utiliza ácido clórico como agente de branqueamento.
- Desinfetante: O ácido clórico atua como desinfetante na indústria de alimentos e bebidas para desinfetar equipamentos e superfícies.
- Condicionador: A indústria de semicondutores usa ácido clórico como agente corrosivo para remover camadas de material indesejadas de wafers semicondutores.
- Reagente de Laboratório: O ácido clórico é usado como reagente de laboratório em química analítica e síntese orgânica.
- Agente oxidante: O ácido clórico é usado como agente oxidante em reações de química orgânica.
- Propulsor de foguete: O ácido clórico serve como oxidante em propelentes de foguete.
- Tratamento de Água: O ácido clórico é usado no tratamento de água para controlar o crescimento de algas e bactérias.
Questões:
P: O ácido clorídrico é um ácido forte?
R: Sim, o ácido clorídrico (HClO3) é um ácido forte.
P: Qual fórmula representa o ácido clorídrico?
R: A fórmula do ácido clórico é HClO3.
P: Explique por que HCl é ácido clorídrico e HClO3 é ácido clorídrico?
R: Os nomes dos ácidos binários (compostos que contêm apenas dois elementos) são geralmente derivados do nome do ânion, com o sufixo -ic para o ânion mais comum e -ous para o menos comum. No caso do HCl, o ânion é o cloreto (Cl-), então o ácido é chamado de ácido clorídrico. No caso do HClO3, o ânion é o clorato (ClO3-), então o ácido é chamado de ácido clorídrico.
P: Qual é a fórmula do ácido clorídrico?
R: A fórmula do ácido clórico é HClO3.
P: O ácido clorídrico é iônico ou molecular?
R: O ácido clórico é molecular porque é composto de átomos de hidrogênio, cloro e oxigênio ligados covalentemente.
