O ácido carbônico (H2CO3) se forma quando o dióxido de carbono se dissolve na água e desempenha um papel crucial na regulação do pH dos oceanos e no controle do desgaste das rochas.
| Nome IUPAC | Ácido carbónico |
| Fórmula molecular | H2CO3 |
| Número CAS | 463-79-6 |
| Sinônimos | Ar ácido; Ar ácido; H2CO3; Oxidaniumilidenmetano; Carbonato ácido; hidroxicetona; Dihidroximetanona |
| InChI | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Fórmula de ácido carbônico
A fórmula química do ácido carbônico é H2CO3, o que indica que ele é composto por dois átomos de hidrogênio, um átomo de carbono e três átomos de oxigênio. A fórmula também mostra a proporção de átomos na molécula, o que é importante para determinar a estequiometria das reações químicas envolvendo o ácido carbônico.
Massa molar de ácido carbônico
A massa molar do ácido carbônico é aproximadamente 62,03 g/mol. É um ácido fraco que se forma quando o dióxido de carbono se dissolve na água e é responsável por regular o pH dos oceanos. A massa molar do ácido carbônico é importante para calcular a quantidade de ácido necessária para atingir um determinado pH em uma solução e para determinar quanto dióxido de carbono pode se dissolver na água.
Ponto de ebulição do ácido carbônico
O ácido carbônico não tem ponto de ebulição bem definido, pois se decompõe em água e dióxido de carbono antes de atingir seu ponto de ebulição. No entanto, à pressão atmosférica, o ácido carbônico se decompõe a uma temperatura de aproximadamente 333 K (60 °C) em água e dióxido de carbono.
Ponto de fusão do ácido carbônico
O ácido carbônico também não possui ponto de fusão bem definido, pois se decompõe em água e dióxido de carbono antes de atingir seu ponto de fusão. No entanto, à pressão atmosférica, o ácido carbônico se decompõe a uma temperatura de aproximadamente 273 K (-0,15 °C) em água e dióxido de carbono.
Densidade de ácido carbônico g/ml
A densidade do ácido carbônico é de aproximadamente 1,67 g/mL à temperatura ambiente (25°C). Este valor pode variar dependendo da concentração da solução, bem como da temperatura e pressão do ambiente.
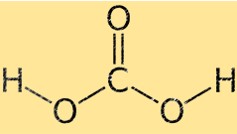
Estrutura do ácido carbônico
O ácido carbônico tem uma geometria molecular tetraédrica, com o átomo de carbono no centro e os quatro átomos circundantes (dois de oxigênio e dois de hidrogênio) localizados nos cantos de um tetraedro. Os dois átomos de oxigênio estão ligados ao átomo de carbono por ligações duplas, enquanto os dois átomos de hidrogênio estão ligados por ligações simples.
Peso molecular do ácido carbônico
O peso molecular do ácido carbônico é 62,03 g/mol. Esse valor é calculado somando os pesos atômicos dos elementos constituintes, que são hidrogênio (H), carbono (C) e oxigênio (O).
| Aparência | Líquido incolor ou sólido cristalino |
| Gravidade Específica | 1,67g/cm³ |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 62,03 g/mol |
| Densidade | 1,67 g/mL à temperatura ambiente (25°C) |
| Ponto de fusão | Decompõe-se a aproximadamente 273 K (-0,15 °C) |
| Ponto de ebulição | Decompõe-se a aproximadamente 333 K (60°C) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Completamente solúvel |
| Solubilidade | Solúvel em água, etanol, metanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 3.6 (primeira dissociação) |
| pH | 5,6 (em solução 0,1M) |
Ácido carbônico Segurança e perigos
O ácido carbônico (H2CO3) é geralmente considerado seguro, mas pode representar alguns perigos em determinadas situações. A exposição ao H2CO3 pode causar irritação nos olhos, pele e sistema respiratório e causar tosse, respiração ofegante e falta de ar. A ingestão de H2CO3 pode causar dores de estômago, náuseas e vômitos. O H2CO3 também é um ácido fraco e pode reagir com certos metais, como alumínio e zinco, para produzir gás hidrogênio inflamável. Ao manusear ou usar H2CO3, devem ser tomadas precauções de segurança apropriadas, incluindo o uso de roupas protetoras e ventilação adequada. Se exposto, deve-se procurar atendimento médico imediatamente.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Não tóxico |
| Números de identificação da ONU | Um 1824 |
| Código SH | 28111990 |
| Classe de perigo | 8 – Substâncias corrosivas |
| Grupo de embalagem | III |
| Toxicidade | Baixa toxicidade |
Métodos de síntese de ácido carbônico
O H2CO3 pode ser sintetizado por diferentes métodos. Um método comum é reagir o dióxido de carbono (CO2) com água (H2O) na presença de um catalisador. Este processo, denominado hidratação, produz ácido carbônico:
CO2 + H2O → H2CO3
Outro método de síntese de ácido carbônico envolve a reação do carbonato de cálcio (CaCO3) com um ácido, como o ácido clorídrico (HCl). Este processo, denominado acidificação, produz ácido carbônico:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
A reação entre o ácido oxálico e um carbonato, como o carbonato de sódio (Na2CO3), permite a síntese do ácido carbônico. Este processo produz ácido carbônico e um sal, como o oxalato de sódio:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
O processo Solvay produz ácido carbônico e bicarbonato de sódio pela reação do carbonato de sódio (Na2CO3) com dióxido de carbono na presença de água.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
No geral, existem vários métodos disponíveis para a síntese de ácido carbônico, cada um com suas vantagens e limitações. A escolha do método dependerá de fatores como a pureza desejada do produto, a disponibilidade de matéria-prima e a escala de produção necessária.
Usos do ácido carbônico
O ácido carbônico (H2CO3) é um composto versátil que encontra muitos usos na indústria, na medicina e na vida cotidiana. Alguns dos principais usos do H2CO3 incluem:
- Bebidas carbonatadas: H2CO3 é o composto responsável pela efervescência característica em bebidas carbonatadas, como refrigerantes e cerveja.
- O H2CO3 amortece o pH em vários processos industriais, como tratamento de água e processamento de alimentos.
- Ele suprime o fogo deslocando o oxigênio e evitando a combustão.
- O H2CO3 inibe o crescimento de bactérias e mofo em certos tipos de produtos alimentícios para preservá-los.
- Atua como um agente de limpeza suave, especialmente para remover depósitos minerais.
- Os profissionais de saúde usam H2CO3 em determinadas aplicações, inclusive para tratar certas lesões cutâneas e induzir constrição brônquica durante testes de função pulmonar.
- Os soldadores usam H2CO3 como gás de proteção para evitar a oxidação e produzir soldas mais limpas.
No geral, o ácido carbônico é um composto útil e versátil que possui uma ampla gama de aplicações em vários campos.
Questões:
P: O ácido carbônico é um ácido forte?
R: O ácido carbônico é um ácido fraco, o que significa que se dissocia apenas parcialmente na água para produzir íons hidrogênio (H+) e íons bicarbonato (HCO3-). Sua constante de dissociação ácida (Ka) é relativamente baixa, indicando que não se dissocia completamente em água.
P: O dióxido de carbono é ácido?
R: O dióxido de carbono (CO2) não é inerentemente ácido, pois é um composto neutro que não produz íons hidrogênio (H+) na água. No entanto, quando o CO2 se dissolve na água, pode reagir com as moléculas de água para formar ácido carbônico, que é um ácido fraco. Essa reação pode fazer com que o pH diminua, tornando a solução mais ácida. Portanto, embora o CO2 em si não seja ácido, pode contribuir para a acidez de uma solução quando reage com a água.
