O acetato de zinco (Zn(C2H3O2)2) é um composto químico. Seus usos são numerosos em indústrias e laboratórios. É solúvel em água e pode formar estruturas cristalinas brancas.
| Nome IUPAC | Acetato de Zinco |
| Fórmula molecular | Zn(C2H3O2)2 |
| Número CAS | 557-34-6 |
| Sinônimos | Diacetato de zinco, etanoato de zinco, sal de zinco de ácido acético |
| InChI | InChI=1S/2C2H4O2.Zn/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriedades do acetato de zinco
Fórmula de acetato de zinco
A fórmula química do etanoato de zinco é Zn(C2H3O2)2. Consiste em um íon zinco (Zn) e dois íons acetato (C2H3O2). A fórmula representa a proporção de átomos presentes no composto.
Massa molar de acetato de zinco
A massa molar do etanoato de zinco pode ser calculada adicionando as massas atômicas de cada elemento na fórmula. Para o zinco (Zn), a massa atômica é 65,38 g/mol, e para o acetato (C2H3O2), é 59,05 g/mol. Portanto, a massa molar do etanoato de zinco é aproximadamente 183,39 g/mol.
Ponto de ebulição do acetato de zinco
O etanoato de zinco não possui ponto de ebulição distinto, pois tende a se decompor e a perder ácido acético quando aquecido. Em vez disso, decompõe-se em óxido de zinco e ácido acético a altas temperaturas.
Ponto de fusão do acetato de zinco
O etanoato de zinco tem um ponto de fusão de aproximadamente 237°C (459°F). A esta temperatura, o composto sólido passa para o estado líquido. O ponto de fusão é uma característica importante usada para identificação.
Densidade de acetato de zinco g/mL
A densidade do etanoato de zinco é de aproximadamente 1,84 g/mL. Densidade é a medida da massa por unidade de volume de uma substância. A densidade do etanoato de zinco é relativamente alta, indicando sua compactação.
Peso molecular do acetato de zinco
O peso molecular do etanoato de zinco é 183,39 g/mol. É a soma dos pesos atômicos de todos os átomos do composto. O peso molecular é crucial para vários cálculos e reações químicas.
Estrutura de acetato de zinco
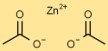
O etanoato de zinco tem uma estrutura simples, com o íon zinco (Zn) em seu centro rodeado por dois íons acetato (C2H3O2). Os íons acetato formam ligações covalentes coordenadas com o íon zinco.
Solubilidade do acetato de zinco
O etanoato de zinco é solúvel em água e outros solventes polares. A solubilidade em água é relativamente alta e forma uma solução incolor. A solubilidade do composto é essencial para suas diversas aplicações em indústrias e laboratórios.
| Propriedade | Valor |
| Aparência | Cristais brancos |
| Gravidade Específica | 1,84g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 183,39 g/mol |
| Densidade | 1,84g/cm³ |
| Ponto de fusão | 237°C (459°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água e outros solventes polares |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Neutro (7) |
Segurança e perigos do acetato de zinco
O etanoato de zinco apresenta riscos mínimos de segurança quando manuseado corretamente. Isto pode causar ligeira irritação na pele e nos olhos. Evite inalação ou ingestão, pois pode causar desconforto respiratório e gastrointestinal. Armazenar em local fresco e seco, longe de substâncias incompatíveis. Use equipamento de proteção adequado durante o manuseio. Em caso de contato, enxaguar as áreas afetadas com água em abundância. Consulte um médico se a irritação persistir. Siga as boas práticas de laboratório e instruções de segurança para evitar acidentes. Embora seja geralmente seguro, o manuseio responsável e as medidas de precaução são essenciais para garantir um ambiente de trabalho seguro.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Provoca irritação ligeira à pele, Provoca irritação ocular, Evitar inalação/ingestão. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 29152900 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos de síntese de acetato de zinco
Existem vários métodos para sintetizar etanoato de zinco. Uma abordagem comum envolve a reação entre o óxido de zinco (ZnO) e o ácido acético (CH3COOH) . As duas substâncias são misturadas e a reação ocorre em alta temperatura. Durante o processo, o óxido de zinco reage com o ácido acético, resultando na formação de etanoato de zinco e água.
Outro método envolve a reação do zinco metálico com ácido acético . O zinco metálico é adicionado ao ácido acético e a reação ocorre, produzindo etanoato de zinco e gás hidrogênio.
Alternativamente, o etanoato de zinco pode ser preparado pela reação do carbonato de zinco (ZnCO3) com ácido acético. O carbonato de zinco reage com o ácido acético para produzir etanoato de zinco, dióxido de carbono e água.
Além disso, o etanoato de zinco pode ser obtido tratando hidróxido de zinco (Zn(OH)2) com ácido acético. A reação entre essas substâncias dá etanoato de zinco e água.
Independentemente do método utilizado, o etanoato de zinco resultante pode ser posteriormente purificado por processos de cristalização ou filtração. Deve-se ter cuidado durante a síntese para garantir a segurança e obter um produto de alta qualidade.
Usos do acetato de zinco
O etanoato de zinco encontra uma ampla gama de aplicações em diversas indústrias devido às suas propriedades versáteis. Alguns de seus usos comuns incluem:
- Indústria farmacêutica: O etanoato de zinco contribui ativamente para a função imunológica e a cicatrização de feridas, à medida que as empresas farmacêuticas o incorporam em vários medicamentos e suplementos dietéticos para fornecer uma fonte de zinco.
- Indústria Têxtil: Na indústria têxtil, é utilizado como mordente em processos de tingimento para fixar e melhorar a solidez da cor dos corantes têxteis nos tecidos.
- Síntese Química: O etanoato de zinco atua como catalisador em reações orgânicas, facilitando os processos de esterificação e acetilação.
- Preservação de madeira: As formulações de tratamento de madeira utilizam etanoato de zinco para proteger contra ataques de fungos e cupins, prolongando a vida útil dos produtos de madeira.
- Galvanização: Na galvanização, o etanoato de zinco atua como precursor na produção de revestimentos de zinco, proporcionando resistência à corrosão ao aço e outros metais.
- Aplicações laboratoriais: Pesquisadores e cientistas usam etanoato de zinco como reagente em vários experimentos laboratoriais e procedimentos analíticos.
- Produtos para a pele: Pomadas e cremes contêm etanoato de zinco por suas propriedades adstringentes e calmantes, benéficas para doenças de pele como acne.
- Descongelador: Algumas áreas usam etanoato de zinco como descongelador ecológico em estradas e calçadas no inverno para evitar a formação de gelo.
- Dessulfurização de gases: O etanoato de zinco encontra aplicação em processos de limpeza de gases para remover compostos de enxofre das emissões industriais.
- Indústria Alimentar: Na indústria alimentar, o etanoato de zinco atua como aditivo alimentar, servindo como regulador de acidez e estabilizador em alguns alimentos processados.
No geral, as diversas aplicações do etanoato de zinco demonstram sua importância em diversas indústrias, tornando-o um composto valioso em diversos processos de fabricação e pesquisa.
Questões:
P: Qual substância é importante na fabricação de plásticos?
R: O ácido acético é essencial na fabricação de plásticos, pois é comumente utilizado como matéria-prima na produção de diversos polímeros sintéticos.
P: O que é acetato de zinco?
R: O etanoato de zinco é um composto químico formado pela reação do óxido de zinco ou zinco metálico com ácido acético, resultando em um sólido cristalino branco.
P: Qual é a fórmula do acetato de zinco?
R: A fórmula do etanoato de zinco é Zn(C2H3O2)2.
P: O acetato de zinco é solúvel?
R: Sim, o etanoato de zinco é solúvel em água e outros solventes polares.
P: O acetato de zinco e o gluconato de zinco são anticoagulantes?
R: Não, o etanoato de zinco e o gluconato de zinco não são anticoagulantes. Estas são formas de zinco usadas como suplementos dietéticos.
P: O ácido acético de zinco é um sólido?
R: O ácido acético de zinco não é um composto específico. Pode referir-se ao produto da reação do zinco com ácido acético, que seria um composto sólido de zinco.
P: Qual elemento e composto tem a mesma reação química que o zinco e o ácido acético?
R: O elemento é o zinco (Zn) e o composto é o óxido de zinco (ZnO), que reage da mesma forma que o zinco e o ácido acético.
P: Qual é a equação balanceada para zinco e ácido acético?
R: A equação balanceada é: Zn + 2CH3COOH → Zn(CH3COO)2 + H2.
P: O que o acetato de zinco faz pela pele?
R: O etanoato de zinco é usado em produtos para a pele por suas propriedades adstringentes, ajudando a acalmar e aliviar doenças da pele como acne.
