O acetato de sódio (C2H3NaO2) é um composto composto por íons Na+ e C2H3O2-. É comumente usado como aditivo alimentar e em aplicações médicas, como em soluções de diálise, e como fonte de carbono para certas bactérias.
| Nome IUPAC | Acetato de sódio |
| Fórmula molecular | C2H3NaO2 |
| Número CAS | 127-09-3 |
| Sinônimos | Sal de sódio de ácido acético, etanoato de sódio, Natriumacetat |
| InChI | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Propriedades do acetato de sódio
Fórmula de acetato de sódio
A fórmula química do acetato de sódio é NaC2H3O2. Isso indica que o composto é composto por um íon Na+ e um íon C2H3O2-. O íon C2H3O2- é composto por um átomo de carbono, dois átomos de oxigênio e três átomos de hidrogênio. A fórmula é útil para determinar a estequiometria de reações químicas e para prever o comportamento do composto sob diferentes condições.
Massa molar de acetato de sódio
NaC2H3O2 tem massa molar de 82,03 g/mol. Isso significa que um mol de NaC2H3O2 pesa 82,03 gramas. A massa molar é calculada somando as massas atômicas de cada elemento do composto. O sódio tem massa de 22,99 g/mol, o carbono tem massa de 12,01 g/mol, o hidrogênio tem massa de 1,01 g/mol e o oxigênio tem massa de 16,00 g/mol. A massa molar de NaC2H3O2 é útil na determinação da quantidade de composto presente em uma determinada amostra.
Ponto de ebulição do acetato de sódio
NaC2H3O2 tem um ponto de ebulição de 881°C (1.618°F). O ponto de ebulição é a temperatura na qual uma substância passa de líquido para gás. O alto ponto de ebulição do NaC2H3O2 é devido às fortes ligações iônicas entre os íons sódio e acetato. Em altas temperaturas, essas ligações são quebradas e o composto vaporiza.
Ponto de fusão de acetato de sódio
NaC2H3O2 tem um ponto de fusão de 324°C (615°F). O ponto de fusão é a temperatura na qual uma substância passa do estado sólido para o estado líquido. O alto ponto de fusão do NaC2H3O2 também se deve às fortes ligações iônicas entre os íons sódio e acetato. Em altas temperaturas, essas ligações são enfraquecidas e o composto derrete.
Densidade de acetato de sódio g/mL
NaC2H3O2 tem densidade de 1,45 g/mL. Densidade é a quantidade de massa por unidade de volume de uma substância. A alta densidade do NaC2H3O2 se deve ao arranjo compacto de suas moléculas. A densidade do NaC2H3O2 pode variar dependendo da sua concentração em uma solução.
Peso molecular do acetato de sódio
O peso molecular do NaC2H3O2 é 82,03 g/mol. É a massa de um mol do composto. O peso molecular é útil para determinar a quantidade de um composto em uma determinada amostra, bem como para calcular a estequiometria de reações químicas.
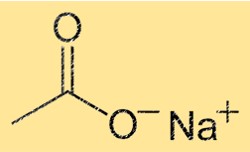
Estrutura do acetato de sódio
O NaC2H3O2 possui uma estrutura cristalina com uma unidade repetitiva Na(CH3COO). Isso significa que cada célula unitária do cristal contém um íon sódio e um íon acetato. O íon Na+ é cercado por seis átomos de oxigênio, enquanto o íon C2H3O2- é composto por um átomo de carbono, dois átomos de oxigênio e três átomos de hidrogênio. As fortes ligações iônicas entre os íons conferem ao cristal sua estabilidade e seus altos pontos de fusão e ebulição.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1,45 a 20°C |
| Cor | Incolor ou branco |
| Cheiro | Inodoro |
| Massa molar | 82,03 g/mol |
| Densidade | 1,45 g/cm³ a 20°C |
| Ponto de fusão | 324°C (615°F) |
| Ponto de ebulição | 881°C (1618°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 820g/L (20°C) |
| Solubilidade | Solúvel em água, etanol, acetona |
| Pressão de vapor | 1 mmHg a 239,2°C |
| Densidade do vapor | Não aplicável |
| pKa | 4,76 (a 25°C) |
| pH | 7 (solução a 1%) |
Segurança e perigos do acetato de sódio
O NaC2H3O2 é geralmente considerado seguro para manusear e usar quando as devidas precauções são tomadas. No entanto, pode causar irritação na pele e nos olhos, e a ingestão ou inalação de grandes quantidades pode causar irritação gastrointestinal, problemas respiratórios e depressão do sistema nervoso central. O NaC2H3O2 também pode reagir com agentes oxidantes fortes, ácidos e álcalis, gerando calor e gases perigosos. É importante usar equipamento de proteção individual adequado ao manusear NaC2H3O2, incluindo luvas e proteção para os olhos. O NaC2H3O2 deve ser armazenado em local fresco, seco e bem ventilado, longe de substâncias incompatíveis. Em caso de exposição ou ingestão acidental, procure atendimento médico imediatamente.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Não ingerir ou inalar. Use em áreas bem ventiladas. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2915.21.00 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos para a síntese de acetato de sódio
Existem vários métodos para sintetizar NaC2H3O2, mas o mais comum envolve a reação de neutralização do ácido acético e do hidróxido de sódio . A equação da reação é a seguinte:
CH3COOH + NaOH → CH3COONa + H2O
Para realizar a reação, uma solução de ácido acético é primeiro preparada dissolvendo ácido acético glacial em água. Enquanto agita, adicione lentamente hidróxido de sódio à solução de ácido acético até que o pH da solução atinja aproximadamente 7.
Neste ponto a solução conterá NaC2H3O2 e água. Para obter NaC2H3O2 sólido, a solução pode ser evaporada em fogo baixo até secar. Alternativamente, a solução pode esfriar até a temperatura ambiente e os cristais de NaC2H3O2 precipitarão por conta própria.
Outro método de síntese de NaC2H3O2 envolve a reação entre anidrido acético e carbonato de sódio . A equação da reação é a seguinte:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Esta reação produz NaC2H3O2, dióxido de carbono, monóxido de carbono e água.
A evaporação da mistura reaccional até à secura e depois a sua cristalização em água pode dar NaC2H3O2 na forma sólida. O alto custo do anidrido acético faz com que esse método seja pouco utilizado.
Usos do acetato de sódio
O NaC2H3O2 é um produto químico versátil com muitas aplicações industriais e científicas. Aqui estão alguns de seus usos comuns:
- Agente tampão: Comumente usado como agente tampão em aplicações químicas e biológicas. Ajuda a manter um pH estável e a prevenir flutuações de acidez.
- Pacotes de Aquecimento: Utilizados na produção de pacotes de aquecimento ou almofadas térmicas. Essas bolsas são pequenas e podem aquecer para fornecer calor a uma área específica do corpo.
- Aditivo alimentar: utilizado como aditivo alimentar, principalmente como intensificador de sabor, regulador de pH e conservante. Os fabricantes de alimentos processados geralmente o incluem em salgadinhos, molhos e produtos cárneos.
- Indústria têxtil: Utilizado na indústria têxtil como auxiliar de tingimento e estamparia. Ajuda a melhorar a absorção do corante e a solidez da cor dos tecidos.
- Síntese química: Utilizado como reagente em diversas reações químicas. Ele converte álcoois nos haletos de alquil correspondentes e produz anidrido acético a partir do ácido acético.
- Aplicações Médicas: Usado em aplicações médicas, como hemodiálise e como componente de soluções eletrolíticas.
- Fotografia: Usado em fotografia como solução fixadora para remover haletos de prata não expostos de impressões fotográficas e negativos.
Questões:
P: Qual é a finalidade do acetato de sódio na síntese de amidas?
R: NaC2H3O2 é usado na síntese de amida como base para desprotonar o grupo amina do material de partida. Isto facilita a reação com o ácido carboxílico para formar a ligação amida.
P: Qual é a finalidade da solução de acetato de sódio na síntese de amidas?
R: A solução de NaC2H3O2 é usada como catalisador básico na síntese de amida. Ajuda a desprotonar o grupo amina do material de partida, tornando-o mais reativo ao ácido carboxílico.
P: O acetato de sódio é à base?
R: Sim, NaC2H3O2 é uma base. É a base conjugada do ácido acético e tem pH em torno de 9 quando dissolvido em água.
P: O que é acetato de sódio?
R: NaC2H3O2 é um sal de sódio do ácido acético, com a fórmula química NaCH3COO. É um pó branco, inodoro e cristalino, solúvel em água.
P: Qual é a finalidade da solução de acetato de sódio na síntese da acetofenetidina amida?
R: Na síntese de amida de acetofenetidina, a solução de NaC2H3O2 é usada como catalisador básico para facilitar a reação entre a p-fenetidina e o anidrido acético. Ajuda a desprotonar o grupo amina da p-fenetidina e ativá-lo para o ataque nucleofílico pelo anidrido acético. Isso resulta na formação de acetofenetidina.
