O acetato de etila é um líquido incolor com odor frutado. É comumente usado como solvente em diversas indústrias, incluindo farmacêutica, cosmética e alimentícia. O acetato de etila é altamente inflamável e deve ser manuseado com cuidado.
| Nome IUPAC | Acetato de etila |
| Fórmula molecular | C4H8O2 |
| Número CAS | 141-78-6 |
| Sinônimos | Éster etílico de ácido acético, etanoato de etila, acetoxietano, acetidina, acetato de etila, éster etil acético |
| InChI | InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
Propriedades do acetato de etila
Densidade de acetato de etila g/ml
A densidade do etanoato de etila é 0,902 g/ml sob condições padrão de temperatura e pressão. Esta densidade indica que o etanoato de etila é menos denso que a água e flutuará sobre ela. Esta propriedade o torna útil para separar misturas líquidas através do processo de extração líquido-líquido.
Estrutura do acetato de etila
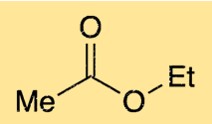
A estrutura do etanoato de etila consiste em uma cadeia de quatro carbonos com um grupo funcional éster. O grupo funcional éster consiste em um átomo de oxigênio ligado a um átomo de carbono, que por sua vez está ligado a outro átomo de oxigênio. O átomo de oxigênio no grupo éster também está ligado a um dos átomos de carbono na cadeia de quatro carbonos. Esta estrutura confere ao etanoato de etila seu odor frutado característico.
Massa molar de acetato de etila
A massa molar do acetato de etila é 88,11 g/mol. É determinado adicionando os pesos atômicos de todos os átomos de uma molécula de acetato de etila. A fórmula molecular do acetato de etila é C4H8O2, o que indica que existem 4 átomos de carbono, 8 átomos de hidrogênio e 2 átomos de oxigênio em cada molécula. A massa molar do acetato de etila é usada em muitos cálculos, como na determinação da quantidade de substância em uma determinada amostra ou na massa de uma substância em um determinado volume.
Ponto de ebulição do acetato de etila
O ponto de ebulição do etanoato de etila é 77,1°C (171,8°F) à pressão padrão. O etanoato de etila tem um ponto de ebulição relativamente baixo, o que o torna útil em muitas aplicações industriais como solvente para extração, purificação e limpeza. Quando aquecido até o ponto de ebulição, o etanoato de etila vaporiza e pode ser coletado como um líquido puro por meio de condensação.
Ponto de fusão do acetato de etila
O ponto de fusão do etanoato de etila é -83,6°C (-118,5°F). Este baixo ponto de fusão significa que o etanoato de etila é geralmente encontrado na forma líquida em vez de sólida à temperatura ambiente. No entanto, pode solidificar a temperaturas extremamente baixas ou sob pressão. A forma sólida do etanoato de etila é geralmente um pó cristalino branco.
Peso molecular de acetato de etila
O peso molecular do etanoato de etila é 88,11 g/mol. Este valor representa a massa de um mol de moléculas de etanoato de etila. O peso molecular é usado em muitos cálculos, como na determinação da quantidade de substância em uma determinada amostra ou na massa de uma substância em um determinado volume.
Fórmula de acetato de etila
A fórmula química do etanoato de etila é C4H8O2. Esta fórmula representa o número e tipo de átomos que constituem uma molécula de etanoato de etila. Os quatro átomos de carbono na fórmula estão dispostos em uma cadeia, com cada átomo de carbono ligado a dois outros átomos. Dois dos átomos de carbono também estão ligados aos átomos de oxigênio no grupo funcional éster. Os dois átomos de carbono restantes estão cada um ligado a três átomos de hidrogênio.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,902g/cm³ |
| Cor | Incolor |
| Cheiro | Frutado, doce |
| Massa molar | 88,11 g/mol |
| Densidade | 0,902g/cm³ |
| Ponto de fusão | -83,6ºC |
| Ponto de ebulição | 77,1ºC |
| Ponto flash | -4ºC |
| Solubilidade em Água | 80 g/L a 20°C |
| Solubilidade | Solúvel em álcool, éter, acetona, clorofórmio |
| Pressão de vapor | 73,3 mmHg a 20°C |
| Densidade do vapor | 3.04 |
| pKa | 4,76 |
| pH | Neutro |
O etanoato de etila é um líquido incolor amplamente utilizado em diversas aplicações industriais e laboratoriais. No entanto, apresenta certos riscos de segurança e saúde que devem ser considerados para garantir um manuseamento e utilização seguros. A exposição ao etanoato de etila pode causar irritação nos olhos, pele e sistema respiratório. Também pode causar dores de cabeça, tonturas e náuseas. O etanoato de etila é inflamável e pode causar incêndios ou explosões se exposto ao calor ou chamas. É importante armazenar e manusear o etanoato de etila em área bem ventilada, longe de fontes de ignição. Em caso de exposição acidental, deve-se procurar atendimento médico imediato para evitar maiores danos. Precauções de segurança e equipamentos de proteção adequados devem ser usados ao manusear etanoato de etila para minimizar o risco de ferimentos ou danos.
| Símbolos de perigo | Xi, F |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Manter afastado de fontes de ignição. Usar em uma área bem ventilada. |
| Identificadores AN | ONU1173 |
| Código SH | 2915.31.00 |
| Classe de perigo | 3 – Líquidos inflamáveis |
| Grupo de embalagem | GE II |
| Toxicidade | LD50 (oral, rato) – 2 g/kg |
Métodos para a síntese de acetato de etila
Dois métodos principais, esterificação e desidrogenação, sintetizam ativamente o etanoato de etila na indústria com altos rendimentos.
O método de esterificação envolve a reação entre etanol e ácido acético na presença de um catalisador ácido forte, como o ácido sulfúrico. A destilação separa o etanoato de etila e a água, resultante da reação, para produzir altos rendimentos de etanoato de etila, que é comumente utilizado na indústria.
O método de desidrogenação envolve a reação de etanol e ácido acético sobre um catalisador de óxido de cobre (II) em alta temperatura. O catalisador promove a desidrogenação do etanol para produzir etileno, que então reage com o ácido acético para formar etanoato de etila. Este método é menos comum que a esterificação e geralmente requer temperaturas mais altas e tempos de reação mais longos.
Outro método de síntese de etanoato de etila envolve a reação de etanol e anidrido acético. Este método resulta na produção de etanoato de etila e ácido acético, que podem ser separados por destilação.
Usos do acetato de etila
O etanoato de etila é um composto químico versátil amplamente utilizado em diversas aplicações industriais e de consumo. Alguns dos usos mais comuns do etanoato de etila são:
- Solvente: Os fabricantes o utilizam como um poderoso solvente em tintas, revestimentos e adesivos.
- Aromatizante: utilizado como aromatizante na indústria de alimentos e bebidas, principalmente na produção de bebidas com sabor de frutas.
- Fragrância: Ingrediente comum em perfumes, colônias e outros produtos de higiene pessoal devido ao seu agradável cheiro frutado.
- Extração de Óleo Essencial: Utilizado na extração de óleos essenciais de plantas e flores.
- Produtos farmacêuticos: Utilizados como solvente na produção de produtos farmacêuticos, principalmente na fabricação de antibióticos.
- Agente de limpeza: utilizado para limpar dispositivos eletrônicos, têxteis e outros materiais.
- Couro artificial: Os fabricantes de couro artificial suavizam e tornam o material mais flexível usando acetato de etila como plastificante.
- Intermediário químico: Os produtores de produtos químicos criam outros produtos químicos, como acetato de celulose, acetato de vinil e acrilato de etila, usando etanoato de etila como intermediário químico.
Questões:
P: O acetato de etila é polar ou apolar?
R: O etanoato de etila é um solvente polar devido à presença do grupo carbonila (C = O) e do átomo de oxigênio em sua estrutura molecular. No entanto, não é tão polar quanto outros solventes como água ou etanol.
P: O acetato de etila é miscível com água?
R: O etanoato de etila é imiscível com água, o que significa que não se mistura bem com água. Isto se deve à diferença de polaridade entre as duas substâncias, pois a água é um solvente altamente polar e o etanoato de etila é um solvente menos polar.
P: O acetato de etila é solúvel em água?
R: O etanoato de etila é ligeiramente solúvel em água, com solubilidade de aproximadamente 8% à temperatura ambiente. No entanto, esta solubilidade é limitada devido à diferença de polaridade entre as duas substâncias. O etanoato de etila é mais solúvel em solventes apolares, como hexano ou tolueno.
