O acetato de cobre (Cu(CH3COO)2) é um composto cristalino azul esverdeado. É formado quando o cobre reage com o ácido acético. Encontra aplicações em diversas indústrias, como catalisadores e fungicidas.
| Nome IUPAC | Acetato de cobre (II) |
| Fórmula molecular | Cu(CH3COO)2 |
| Número CAS | 142-71-2 |
| Sinônimos | Acetato cúprico, sal de cobre do ácido acético, diacetato de cobre |
| InChI | InChI=1S/2C2H4O2.Cu/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriedades do acetato de cobre
Fórmula de acetato de cobre
O acetato cúprico tem a fórmula química Cu(CH3COO)2. Consiste em um átomo de cobre (Cu) ligado a dois grupos acetato (CH3COO). A fórmula representa a proporção de elementos no composto.
Massa molar de acetato de cobre
A massa molar do acetato cúprico pode ser calculada somando as massas atômicas de seus elementos constituintes. O cobre (Cu) tem massa molar de 63,55 g/mol, enquanto o acetato (CH3COO) tem massa molar de 59,04 g/mol. Assim, a massa molar do acetato cúprico é 181,63 g/mol.
Ponto de ebulição do acetato de cobre
O acetato cúprico se decompõe antes de atingir o ponto de ebulição devido à sua instabilidade térmica. Seu ponto de ebulição não está, portanto, bem definido. Em vez disso, sofre decomposição quando aquecido significativamente.
Ponto de fusão do acetato de cobre
O acetato cúprico normalmente derrete entre 115°C e 120°C (239°F e 248°F). O ponto de fusão pode variar ligeiramente dependendo da pureza do composto.
Densidade de acetato de cobre g/mL
A densidade do acetato cúprico é de aproximadamente 1,882 g/mL. Este valor corresponde à massa de acetato cúprico por unidade de volume. A densidade pode variar com mudanças de temperatura e pressão.
Peso molecular do acetato de cobre
O peso molecular do acetato cúprico, calculado a partir de sua fórmula, é 181,63 g/mol. Representa a soma dos pesos atômicos de todos os átomos presentes em uma molécula de acetato cúprico.
Estrutura de acetato de cobre
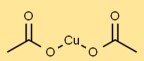
O acetato cúprico possui uma estrutura cristalina em sua forma sólida. Os átomos de cobre são coordenados com grupos acetato, formando um arranjo estável. Aparece como cristais azul-esverdeados devido à sua geometria de coordenação.
Solubilidade do acetato de cobre
O acetato cúprico tem solubilidade moderada em água. Pode dissolver-se em solventes polares devido à presença de íons acetato. Contudo, a solubilidade pode ser limitada e a sua dissolução pode ser influenciada pela temperatura e pelo pH.
| Aparência | Sólido cristalino azul esverdeado |
| Gravidade Específica | 1.882g/mL |
| Cor | Azul verde |
| Cheiro | Inodoro |
| Massa molar | 181,63 g/mol |
| Densidade | 1.882g/mL |
| Ponto de fusão | 115°C – 120°C (239°F – 248°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solubilidade moderada em água |
| Solubilidade | Solúvel em solventes polares, ligeiramente solúvel em éter e glicerol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Ácido (cerca de 4-5) |
Segurança e perigos do acetato de cobre
O acetato cúprico apresenta certas preocupações e perigos de segurança. É fundamental manuseá-lo com cuidado e seguir os protocolos de segurança. O contato direto com o composto pode causar irritação na pele e nos olhos. A inalação de poeira ou vapores pode causar desconforto respiratório. Evite a ingestão, pois pode ser prejudicial. Mantenha-o afastado de materiais incompatíveis e fontes de calor ou ignição para evitar risco de incêndio. Em caso de exposição acidental, lavar imediatamente as áreas afetadas e procurar atendimento médico. Armazene o acetato de cobre em uma área segura e bem ventilada, longe do alcance de crianças e pessoas não autorizadas. Sempre use equipamento de proteção individual adequado ao trabalhar com este composto.
| Símbolos de perigo | Corrosivo, Tóxico Agudo, Irritante |
| Descrição de segurança | Evite o contato direto com a pele e os olhos. Usar em uma área bem ventilada. Manuseie com cuidado. |
| Números de identificação da ONU | Não atribuído |
| Código SH | 29152900 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | III (Baixo perigo) |
| Toxicidade | Pode causar irritação na pele e nos olhos. A inalação pode causar desconforto respiratório. Evite ingerir. |
Métodos para a síntese de acetato de cobre
Existem vários métodos para sintetizar o acetato cúprico.
Uma abordagem comum envolve a reação entre óxido de cobre (CuO) ou hidróxido de cobre (Cu(OH)2) com ácido acético (CH3COOH). Eles combinam e agitam as duas substâncias, o que leva à formação de acetato cúprico e água. Outro método é a reação do carbonato de cobre (CuCO3) com ácido acético, produzindo acetato cúprico, dióxido de carbono (CO2) e água.
Um método alternativo de síntese envolve a reação do cobre metálico com uma mistura de ácido acético e peróxido de hidrogênio (H2O2). Esta reação leva à formação de acetato cúprico e água. O acetato cúprico resulta da reação entre sulfato de cobre (II) (CuSO4) e acetato de cálcio (Ca(CH3COO)2. Esta reação produz acetato cúprico e sulfato de cálcio (CaSO4).
Aquecer e refluxar uma mistura de pó de cobre e ácido acético glacial produz acetato cúprico. Este processo leva à formação de acetato cúprico. A disponibilidade de reagentes e a pureza desejada do produto final determinam as vantagens distintas de cada método.
Usos do acetato de cobre
O acetato de cobre encontra aplicações versáteis em diversos setores devido às suas propriedades únicas. Aqui estão alguns usos importantes:
- Catalisador: O acetato cúprico catalisa muitas reações orgânicas, incluindo a síntese de acetato de vinila e anidrido acético.
- Galvanoplastia: O acetato cúprico auxilia nos processos de galvanoplastia, conferindo uma fina camada de cobre aos objetos metálicos, melhorando sua aparência e resistência à corrosão.
- Intermediários Químicos: O composto desempenha um papel crucial como intermediário na produção de vários produtos químicos, como óxido de cobre, naftenato de cobre e sabões de cobre.
- Preservante de Madeira: O acetato de cobre atua como preservante de madeira, protegendo a madeira do ataque de fungos e insetos, comumente usado para preservar dormentes de ferrovias e postes de serviços públicos.
- Fungicida: Na agricultura, o acetato de cobre é utilizado como fungicida para controlar doenças fúngicas nas culturas, especialmente em vinhas e pomares.
- Pirotecnia: O acetato de cobre encontra aplicação em formulações pirotécnicas, produzindo cores azuis e verdes vibrantes em fogos de artifício e sinalizadores.
- Tingimento têxtil: Atua como mordente nos processos de tingimento têxtil, facilitando a ligação dos corantes às fibras.
- Reagente de Laboratório: O composto atua como reagente em experimentos de laboratório para análises qualitativas e quantitativas.
- Química Analítica: O acetato de cobre é usado como reagente de teste em química analítica para detectar gás sulfeto de hidrogênio.
- Repelente de Animais: Funciona como um repelente de animais para dissuadir certas pragas e animais selvagens de áreas específicas.
As diversas aplicações do acetato cúprico destacam sua importância em diversas indústrias, desde a síntese química até a agricultura e muito mais. O manuseio cuidadoso e o cumprimento das precauções de segurança são essenciais ao usar este composto em diferentes processos.
Questões:
P: O acetato de cobre II é covalente?
R: Não, o acetato cúprico II é um composto iônico.
P: Qual é o coeficiente de extinção molar em 625 nm para esta solução de acetato de cobre II?
R: O coeficiente de extinção molar a 625 nm para solução de acetato cúprico II é específico da concentração da solução e deve ser determinado experimentalmente.
P: Você pode colocar acetato cúprico monohidratado em uma fossa séptica?
R: O acetato de cobre monohidratado não é recomendado para uso como fossa séptica ou limpador de ralos devido a riscos potenciais e preocupações ambientais.
P: Ocorre uma reação quando soluções aquosas de acetato de bário e brometo de cobre (II) são combinadas?
R: Sim, ocorre uma reação quando soluções aquosas de acetato de bário e brometo cúprico (II) são combinadas, resultando na formação de um precipitado (brometo de bário) e acetato cúprico solúvel.
P: Qual é o ponto de fusão do acetato cúprico?
R: O ponto de fusão do acetato cúprico é de aproximadamente 115°C a 120°C (239°F a 248°F).
P: Como fazer acetato cúprico a partir de sulfato de cobre?
R: Para fazer acetato cúprico a partir de CuSO4, dissolva CuSO4 em água e adicione ácido acético à solução até que o acetato cúprico precipite. Filtre e seque o produto.
P: O que é acetato cúprico?
R: O acetato cúprico é um composto químico com a fórmula Cu(CH3COO)2. É um sólido cristalino azul esverdeado e possui diversas aplicações industriais.
P: O acetato cúprico é solúvel em água?
R: Sim, o acetato cúprico é moderadamente solúvel em água, formando uma solução azul esverdeada.
P: Por que a solução de acetato cúprico está turva?
R: A solução de acetato cúprico pode ficar turva devido à presença de impurezas ou à formação de compostos de cobre insolúveis, especialmente se a solução não for preparada ou armazenada adequadamente.
P: Oxidação de Cu (OAc) 2?
R: O acetato de cobre (II) (Cu (OAc) 2) pode atuar como agente oxidante em certas reações, onde sofre redução enquanto oxida outras substâncias.
