O acetato de cálcio (Ca(C2H3O2)2) é um composto composto de cálcio e ácido acético. É comumente usado como medicamento para reduzir os níveis de fosfato em pessoas com doença renal.
| Nome IUPAC | Acetato de cálcio |
| Fórmula molecular | Ca(C2H3O2)2 |
| Número CAS | 62-54-4 |
| Sinônimos | Ácido acético, sal de cálcio; Acetato de cálcio (francês); Diacetato de cálcio; Etanoato de cálcio; E263 |
| InChI | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriedades do acetato de cálcio
Fórmula de acetato de cálcio
A fórmula do acetato de cálcio é Ca(C2H3O2)2. Esta fórmula indica que um mol de acetato de cálcio contém um mol de íons cálcio (Ca2+) e dois moles de íons acetato (C2H3O2-). A fórmula do acetato de cálcio é essencial para determinar a estequiometria das reações químicas envolvendo este composto.
Massa molar de acetato de cálcio
A massa molar de Ca(C2H3O2)2 é 158,17 g/mol. Este valor representa a massa de um mol de Ca(C2H3O2)2, que é igual ao seu peso molecular. A massa molar é um parâmetro crucial na determinação da estequiometria de reações químicas envolvendo Ca(C2H3O2)2. Este valor é calculado somando as massas atômicas de todos os átomos presentes em um mol de Ca(C2H3O2)2.
Ponto de ebulição do acetato de cálcio
O ponto de ebulição do Ca(C2H3O2)2 é 160°C (320°F). Este valor indica a temperatura na qual o Ca(C2H3O2)2 muda seu estado de líquido para gasoso. O ponto de ebulição do Ca(C2H3O2)2 é significativamente mais elevado do que o da água, que ferve a 100°C (212°F). Este alto ponto de ebulição é devido à natureza iônica do Ca(C2H3O2)2 e às suas fortes forças intermoleculares.
Ponto de fusão de acetato de cálcio
O ponto de fusão do Ca(C2H3O2)2 é 160-170°C (320-338°F). Este valor indica a temperatura na qual o Ca(C2H3O2)2 muda seu estado de sólido para líquido. O ponto de fusão do Ca(C2H3O2)2 é ligeiramente superior ao da água, que derrete a 0°C (32°F). O alto ponto de fusão do Ca(C2H3O2)2 é devido à natureza iônica do composto e às suas fortes forças intermoleculares.
Densidade de acetato de cálcio g/mL
A densidade do Ca(C2H3O2)2 é 1,5 g/mL. Este valor indica a massa de Ca(C2H3O2)2 presente em um mililitro de sua solução. A densidade do Ca(C2H3O2)2 é maior que a da água, que tem densidade de 1 g/mL. A alta densidade do Ca(C2H3O2)2 se deve à sua natureza iônica e à presença de íons cálcio no composto.
Peso molecular do acetato de cálcio
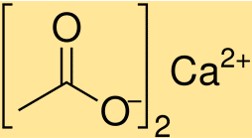
O peso molecular do Ca(C2H3O2)2 é 158,17 g/mol. Este valor representa a soma dos pesos atômicos de todos os átomos presentes em uma molécula de Ca(C2H3O2)2. O peso molecular é um parâmetro crítico na determinação das propriedades do Ca(C2H3O2)2 e seu comportamento em reações químicas.
Estrutura do acetato de cálcio
A estrutura do Ca(C2H3O2)2 é um composto iônico no qual os íons Ca2+ estão rodeados por dois íons C2H3O2-. Os íons C2H3O2- atuam como ligantes bidentados e formam ligações de coordenação com os íons Ca2+. A estrutura do Ca(C2H3O2)2 é cristalina e tem formato cúbico.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 1,5 g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 158,17 g/mol |
| Densidade | 1,5 g/ml |
| Ponto de fusão | 160-170°C (320-338°F) |
| Ponto de ebulição | 160°C (320°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, etanol e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 9.24 |
| pH | 7-8 (solução a 5%) |
Segurança e perigos do acetato de cálcio
Ca(C2H3O2)2 é geralmente considerado seguro quando usado conforme as instruções. Contudo, a exposição a grandes quantidades de Ca(C2H3O2)2 pode irritar a pele, os olhos e o sistema respiratório. A ingestão de grandes quantidades de Ca(C2H3O2)2 pode causar dores de estômago, vômitos e diarreia. É importante manusear o Ca(C2H3O2)2 com cuidado e evitar inalar ou ingerir a substância. O Ca(C2H3O2)2 também pode representar um risco para o meio ambiente, especialmente para a vida aquática, e deve ser descartado de maneira adequada. Tal como acontece com todos os produtos químicos, é importante ler e seguir as instruções de segurança no rótulo e usar equipamento de proteção adequado ao manusear Ca(C2H3O2)2.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite inalação, ingestão e contato com a pele e os olhos. Use em uma área bem ventilada e use equipamento de proteção adequado. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 291529 |
| Classe de perigo | Não classificado como perigoso segundo a Comunicação de Perigos da OSHA (29 CFR 1910.1200). |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade. Pode causar irritação na pele e nos olhos. A ingestão de grandes quantidades pode causar distúrbios gastrointestinais. |
Métodos para a síntese de acetato de cálcio
Vários métodos podem ser usados para sintetizar Ca(C2H3O2)2.
Um método comum envolve a reação do carbonato de cálcio com ácido acético. Adicione o carbonato de cálcio a uma solução de ácido acético e aqueça a mistura ao refluxo. Filtre a mistura e deixe o filtrado esfriar e cristalizar para formar Ca(C2H3O2)2.
Outro método envolve a reação do hidróxido de cálcio com ácido acético . Adicione hidróxido de cálcio à solução de ácido acético. Mexa e aqueça a mistura para obter uma solução límpida. Filtre a solução e deixe o filtrado esfriar e cristalizar para formar Ca(C2H3O2)2.
Outro método envolve a reação do óxido de cálcio com ácido acético . Adicione óxido de cálcio à solução de ácido acético. Mexa e aqueça a mistura para obter uma solução límpida. Filtre a solução e deixe o filtrado esfriar e cristalizar para formar Ca(C2H3O2)2.
A escolha do método de síntese pode depender de fatores como o rendimento e pureza desejados do produto, bem como a aplicação específica para a qual o Ca(C2H3O2)2 será utilizado.
Usos do acetato de cálcio
Ca(C2H3O2)2 tem diversas aplicações em diversos campos. Aqui estão alguns usos comuns de Ca(C2H3O2)2:
- Aditivo alimentar: Utilizado como aditivo alimentar, principalmente em produtos de panificação, para melhorar a textura e prolongar a vida útil.
- Aplicações medicinais: Usado como medicamento para o tratamento de níveis elevados de fosfato no sangue em pacientes com doença renal crônica. Atua ligando-se ao fosfato encontrado nos alimentos e impedindo sua absorção pelo organismo.
- Tratamento de Água: Usado no tratamento de água para reduzir os níveis de chumbo e outros metais pesados.
- Reagente de Laboratório: Utilizado como reagente em laboratórios para diversas reações químicas.
- Agente antifúngico: Também utilizado como agente antifúngico no tratamento de certas infecções de pele.
- Acelerador de concreto: Utilizado como acelerador de concreto, o que ajuda a acelerar o processo de pega do concreto.
- Retardador de chama: Usado como retardador de chama em vários materiais, incluindo plásticos e têxteis.
Questões:
P: O acetato de cálcio é ácido, básico ou neutro?
R: Ca(C2H3O2)2 é um composto básico.
P: O acetato de cálcio é solúvel em água?
R: Sim, Ca(C2H3O2)2 é solúvel em água.
P: Como fazer acetato de cálcio?
R: O Ca(C2H3O2)2 pode ser produzido por vários métodos, incluindo a reação de carbonato de cálcio ou hidróxido de cálcio com ácido acético. A mistura resultante é então filtrada e o filtrado é deixado esfriar e cristalizar, formando Ca(C2H3O2)2.
P: Onde comprar acetato de cálcio?
R: O Ca(C2H3O2)2 pode ser adquirido em fornecedores de produtos químicos, lojas de materiais de laboratório e varejistas on-line.
P: O acetato de cálcio é iônico ou covalente?
R: Ca(C2H3O2)2 é um composto iônico composto de cátions de cálcio e ânions acetato mantidos juntos por ligações iônicas.
