O acetato de amônio é um composto utilizado em diversas indústrias. Atua como fonte de íons acetato e desempenha um papel em reações químicas e síntese orgânica.
| Nome IUPAC | Acetato de amónio |
| Fórmula molecular | C2H7NO2 |
| Número CAS | 631-61-8 |
| Sinônimos | Sal de amônio de ácido acético, etanoato de amônio, ácido acético de amônio, ácido acético, sal de amônio |
| InChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Propriedades do acetato de amônio
Fórmula de acetato de amônio
A fórmula do sal de amônio do ácido acético é C2H7NO2. Consiste em dois átomos de carbono, sete átomos de hidrogênio, um átomo de nitrogênio e dois átomos de oxigênio.
Massa molar de acetato de amônio
A massa molar do sal de amônio do ácido acético é calculada somando as massas atômicas de seus elementos constituintes. Isso é aproximadamente 77,0825 gramas por mol.
Ponto de ebulição do acetato de amônio
O sal de amônio do ácido acético tem um ponto de ebulição em torno de 117 graus Celsius. A esta temperatura, o composto sofre uma mudança de fase de líquido para gasoso.
Ponto de fusão de acetato de amônio
O ponto de fusão do sal de amônio do ácido acético é de aproximadamente 114 graus Celsius. Esta é a temperatura na qual o composto sólido passa para o estado líquido.
Densidade de acetato de amônio g/mL
A densidade do sal de amônio do ácido acético é de aproximadamente 1,17 gramas por mililitro. É uma medida da massa por unidade de volume do composto.
Peso molecular do acetato de amônio
O peso molecular do sal de amônio do ácido acético é de aproximadamente 77,0825 gramas por mol. É a soma dos pesos atômicos de todos os átomos presentes no composto.
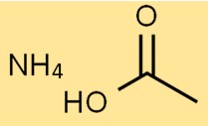
Estrutura do acetato de amônio
A estrutura do sal de amônio do ácido acético consiste em um íon NH4+ e um íon CH3COO-. O íon NH4+ tem carga positiva, enquanto o íon CH3COO- tem carga negativa.
Solubilidade do acetato de amônio
O sal de amônio do ácido acético é altamente solúvel em água. Dissolve-se facilmente em água para formar uma solução límpida e incolor. A solubilidade do sal de amônio do ácido acético em água se deve à sua capacidade de formar ligações de hidrogênio com moléculas de água.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1,17g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 77,0825 g/mol |
| Densidade | 1,17g/ml |
| Ponto de fusão | 114°C |
| Ponto de ebulição | 117°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | muito solúvel em água |
| Solubilidade | Solúvel em água, ácido acético, etanol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | 4,75 |
| pH | Cerca de 6,0-7,0 |
Segurança e perigos do acetato de amônio
O sal de amônio do ácido acético apresenta riscos mínimos de segurança quando manuseado corretamente. Seu uso é geralmente considerado seguro em diversas aplicações. No entanto, como acontece com qualquer produto químico, devem ser tomadas precauções. Evite a inalação de poeiras ou vapores, pois isso pode causar irritação do trato respiratório. É aconselhável usar equipamento de proteção individual adequado, incluindo luvas e óculos de segurança, ao trabalhar com sal de amônio de ácido acético. Em caso de ingestão acidental ou contato com os olhos ou a pele, enxaguar com água abundante e consultar um médico se necessário. Armazene o sal de amônio do ácido acético em local fresco e seco, longe de substâncias incompatíveis. Siga os procedimentos adequados de manuseio e descarte para garantir a segurança.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Baixa toxicidade |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2915.29.10 |
| Classe de perigo | O sal de amônio do ácido acético não é classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos para a síntese de acetato de amônio
Existem vários métodos para sintetizar o sal de amônio do ácido acético. Uma abordagem comum é misturar ácido acético com uma solução aquosa de carbonato de amônio . A reação entre eles produz sal de amônio e água acética. Este método requer o controle da temperatura e da pressão durante a reação.
Em outro método, os químicos adicionam gradualmente ácido acético a uma solução de amônia enquanto agitam até atingir o pH desejado. Este processo de neutralização converte o ácido acético no sal de amônio do ácido acético. A mistura cuidadosa e o controle do pH são essenciais durante esta reação.
Use hidróxido de amônio para sintetizar sal de amônio de ácido acético, combinando-o com ácido acético , resultando na formação de sal de amônio de ácido acético e água. Monitore o progresso desta reação até que esteja completa.
Misture anidrido acético com hidróxido de amônio ou amônia para preparar o sal de amônio do ácido acético. A reação entre esses reagentes resulta na formação de um sal de amônio de ácido acético.
Lembre-se que é imprescindível realizar a síntese do sal de amônio do ácido acético em local bem ventilado e seguir as medidas de segurança adequadas. Durante todo o processo de síntese, garanta o manuseio e armazenamento adequados dos produtos químicos.
Usos do acetato de amônio
O sal de amônio do ácido acético encontra diversas aplicações em diferentes indústrias devido às suas propriedades versáteis. Aqui estão alguns usos comuns:
- O sal de amônio do ácido acético tampona soluções e mantém um nível de pH estável em laboratórios químicos e biológicos.
- Métodos analíticos como cromatografia e espectrometria de massa utilizam o sal de amônio do ácido acético como reagente para ionização e separação de compostos.
- A biologia molecular utiliza o sal de amônio do ácido acético para precipitar o DNA durante os procedimentos de purificação, removendo assim contaminantes e impurezas.
- O sal de amônio do ácido acético participa de diversas reações químicas, atuando como fonte de íons acetato em síntese orgânica, reações de esterificação e processos catalíticos.
- Na agricultura, o sal de amônio do ácido acético serve como fonte de nitrogênio em fertilizantes, promovendo o crescimento e desenvolvimento das plantas.
- As indústrias têxteis utilizam o sal de amônio do ácido acético para tingir e estampar tecidos, melhorando assim a solidez da cor ao fixar os corantes ao tecido.
- A indústria alimentícia aprova o sal de amônio do ácido acético como aditivo alimentar, regulando a acidez para controlar o pH de diversos produtos alimentícios.
- Em técnicas de análise química como HPLC (cromatografia líquida de alta eficiência), o sal de amônio do ácido acético facilita a separação e detecção de compostos.
No geral, o sal de amônio do ácido acético é um composto versátil com utilizações que vão desde aplicações laboratoriais até a agricultura e a indústria alimentícia. Suas propriedades únicas o tornam um ingrediente importante em diversos processos e produtos.
Questões:
P: Quantos átomos de hidrogênio existem em uma molécula de acetato de amônio, NH4C2H3O2?
R: Existem quatro átomos de hidrogênio em uma molécula de sal de amônio do ácido acético (NH4C2H3O2).
P: O acetato de amônio é solúvel?
R: Sim, o sal de amônio do ácido acético é solúvel em água.
P: Qual é a fórmula do acetato de amônio?
R: A fórmula do sal de amônio do ácido acético é NH4C2H3O2.
P: O acetato de amônio é solúvel em água?
R: Sim, o sal de amônio do ácido acético é solúvel em água.
P: Como preparar acetato de amônio 1M?
R: Para preparar sal de amônio 1M de ácido acético, dissolva a quantidade apropriada de acetato de amônio em água para obter uma concentração de 1 mol por litro (M).
P: Quantos moles totais de íons são liberados quando 0,624 moles de acetato de amônio são dissolvidos em água?
R: Quando 0,624 moles de sal de amônio de ácido acético são dissolvidos em água, um total de 1,248 moles de íons (NH4+ e C2H3O2-) são liberados.
P: Qual é o peso molecular exato do acetato de amônio (NH4OAc)?
R: O peso molecular exato do sal de amônio do ácido acético (NH4OAc) é de aproximadamente 77,0825 gramas por mol.
P: Como fazer acetato de amônio 5M?
R: Para preparar sal de amônio 5M de ácido acético, dissolva a quantidade apropriada de acetato de amônio em água para atingir uma concentração de 5 moles por litro (M).
P: Qual é o pKa do ácido acético e o pKb do hidróxido de amônio?
R: O pKa do ácido acético é aproximadamente 4,75 e o pKb do sal de amônio do ácido acético é aproximadamente 4,25.
