A acetamida é um sólido cristalino branco com um leve odor. É sintetizado pela reação do ácido acético com amônia. É comumente usado na fabricação de plásticos e produtos farmacêuticos.
| Nome IUPAC | Etanamida |
| Fórmula molecular | C2H5NO |
| Número CAS | 60-35-5 |
| Sinônimos | Amida de ácido acético, etamida, etanamida, CH3CONH2 |
| InChI | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
Propriedades da Acetamida
Massa molar de acetamida
A acetamida tem massa molar de 59,07 g/mol, que é a soma das massas atômicas de todos os átomos de uma molécula de acetamida. A massa molar de um composto é útil para determinar o número de moles do composto presente em uma determinada amostra. Também é usado para calcular a composição percentual em massa do composto.
Ponto de ebulição da acetamida
O ponto de ebulição da etanamida é 222°C. Esta é a temperatura na qual a etanamida muda de líquido para gás. O ponto de ebulição de uma substância é afetado pela força de suas forças intermoleculares, e a etanamida possui fortes ligações de hidrogênio entre suas moléculas. Portanto, tem um ponto de ebulição relativamente alto em comparação com outras amidas.
Ponto de fusão da acetamida
O ponto de fusão da etanamida é 82,5°C. Esta é a temperatura na qual a etanamida muda de sólida para líquida. O ponto de fusão de uma substância é influenciado pela força das suas forças intermoleculares e, no caso da etanamida, existem fortes ligações de hidrogénio entre as suas moléculas. Portanto, o seu ponto de fusão é relativamente elevado em comparação com outras amidas.
Densidade de Acetamida g/ml
A densidade da etanamida é 1,16 g/mL. Densidade é a massa de uma substância por unidade de volume e é uma propriedade física útil para identificar e caracterizar substâncias. A acetamida é um composto relativamente denso e sua densidade pode ser usada em cálculos para diversas aplicações.
Peso molecular da acetamida
O peso molecular da acetamida é 59,07 g/mol. Este valor é útil para determinar a quantidade de acetamida presente numa amostra, bem como para cálculos estequiométricos em reações químicas.
Estrutura da acetamida
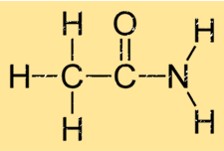
A acetamida tem uma estrutura simples que consiste em um grupo carbonila (C=O) ligado a um grupo amino (NH2). Isso lhe dá a fórmula molecular C2H5NO. Os grupos carbonila e amino são unidos por um único átomo de carbono. A estrutura da etanamida permite formar fortes ligações de hidrogênio com outras moléculas de etanamida, o que contribui para suas propriedades físicas, como ponto de ebulição e ponto de fusão.
Fórmula de Acetamida
A fórmula química da etanamida é CH3CONH2, o que indica que ela contém um átomo de carbono, dois átomos de hidrogênio, um átomo de nitrogênio e um átomo de oxigênio. A fórmula é útil para identificar os elementos e suas proporções presentes no composto. Também é útil para determinar a estequiometria de reações químicas envolvendo etanamida.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1,16g/ml |
| Cor | Incolor |
| Cheiro | Cheiro leve |
| Massa molar | 59,07 g/mol |
| Densidade | 1,16g/ml |
| Ponto de fusão | 82,5ºC |
| Ponto de ebulição | 222ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Completamente miscível |
| Solubilidade | Solúvel em etanol, éter, benzeno e clorofórmio |
| Pressão de vapor | 0,000138 mmHg a 25°C |
| Densidade do vapor | 2.1 |
| pKa | 16,5 |
| pH | 6,5 – 7,5 (solução aquosa a 10%) |
Segurança e perigos da acetamida
A acetamida é considerada um composto relativamente seguro, mas ainda pode representar alguns perigos. Pode causar irritação na pele, olhos e sistema respiratório com exposição prolongada. Também pode causar irritação gastrointestinal e depressão do sistema nervoso central se ingerido. A acetamida é combustível e pode causar incêndios se exposta ao calor ou chamas. É importante manusear a etanamida com cuidado e utilizar equipamentos de proteção, como luvas e óculos de segurança, ao trabalhar com ela. Ventilação e armazenamento adequados também são necessários para evitar exposição desnecessária e minimizar riscos potenciais.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite exposição prolongada. Use equipamento de proteção. Ventilação e armazenamento adequados são necessários. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 29242990 |
| Classe de perigo | Não classificado como perigoso pela OSHA ou GHS |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato): 3,8 g/kg; LC50 (inalação, rato): >20 mg/L (exposição de 4 horas) |
Métodos de síntese de acetamida
A amônia ou os sais de amônio podem reagir com o ácido acético para sintetizar a etanamida, a amônia pode reagir com o cloreto de acetila para sintetizar a etanamida e o acetato de amônio pode sofrer desidratação para sintetizar a etanamida.
No primeiro método, o óxido de zinco ou cobre catalisa a reação do ácido acético e da amônia ou sais de amônio para sintetizar a etanamida. A reação produz etanamida e água como subprodutos.
No segundo método, uma base como hidróxido de sódio ou gás amônia reage com cloreto de acetila para produzir etanamida. A reação produz etanamida e gás cloreto de hidrogênio como subprodutos.
No terceiro método, um agente desidratante como o ácido sulfúrico facilita a desidratação do acetato de amônio para sintetizar etanamida e água como subproduto.
Usos da Acetamida
A acetamida tem muitos usos em diferentes indústrias devido às suas propriedades únicas. Alguns dos usos comuns da etanamida são:
- Solvente: Os fabricantes costumam usá-lo como solvente para produzir plásticos, fibras e resinas.
- Indústria farmacêutica: Utilizado na indústria farmacêutica como matéria-prima para a síntese de diversos medicamentos e também como estabilizador de determinados antibióticos.
- Indústria têxtil: Utilizado na indústria têxtil como amaciante de fibras sintéticas, como o náilon, e como agente de tingimento de algodão e outras fibras naturais.
- Indústria química: Também utilizado como intermediário químico na produção de diversos produtos químicos, como acrilonitrila, anidrido acético e acrilamida.
- Indústria alimentícia: utilizado como aromatizante e ingrediente em alguns produtos alimentícios, como assados, doces e sorvetes.
- Pesquisa Laboratorial: Utilizado em pesquisas laboratoriais como solvente, reagente e também como desnaturante de proteínas.
Questões:
P: Qual reagente ou sequência de reagentes converterá a acetamida em acetato de etila?
R: A acetamida pode ser convertida em acetato de etila fazendo-a reagir com cloroformato de etila na presença de uma base como a piridina. A reação produz acetato de etila, dióxido de carbono e gás cloreto de hidrogênio como subprodutos.
P: A acetamida é um aminoácido?
R: Não, a etanamida não é um aminoácido. É um derivado do ácido acético e contém um grupo funcional amida (-CONH2) em vez de um grupo amino (-NH2).
P: Qual é o produto da reação da acetamida com HO-?
R: A reação da acetamida com HO- (íon hidróxido) resulta na hidrólise da acetamida para formar ácido acético e amônia.
P: Como removo o solvente acetamida dos cristais?
R: Para remover o solvente etanamida dos cristais, podem ser utilizadas técnicas como recristalização ou filtração a vácuo. A recristalização envolve a dissolução dos cristais em um solvente adequado, como a água, e depois permitir que o solvente evapore lentamente para obter cristais puros. A filtração a vácuo envolve a filtragem dos cristais através de papel de filtro sob pressão reduzida para remover qualquer solvente residual de etanamida.
P: A acetamida tem uma ligação de hidrogênio?
R: Sim, a etanamida pode participar de ligações de hidrogênio devido à presença de um aceitador de ligações de hidrogênio (-CO) e de um doador de ligações de hidrogênio (-NH2) em sua estrutura molecular.
