O hidreto de alumínio e lítio (LiAlH4) é um poderoso agente redutor usado na química orgânica para converter compostos carbonílicos em álcoois. Reage vigorosamente com água.
| Nome IUPAC | Hidreto de alumínio e lítio |
| Fórmula molecular | LiAlH4 |
| Número CAS | 16853-85-3 |
| Sinônimos | Tetrahidridoaluminato de lítio (III), hidreto de alumínio (III) de lítio |
| InChI | InChI=1S/Al.Li.4H |
Propriedades do hidreto de alumínio e lítio (LiAlH4)
Fórmula de hidreto de alumínio e lítio (LiAlH4)
A fórmula do tetraidridoaluminato de lítio (LiAlH4) representa sua composição. Consiste em um átomo de lítio (Li), um átomo de alumínio (Al) e quatro átomos de hidrogênio (H). A fórmula está escrita LiAlH4, indicando a presença desses elementos.
Hidreto de Alumínio e Lítio (LiAlH4) Massa molar
A massa molar do tetrahidridoaluminato de lítio (LiAlH4) é a soma das massas atômicas de seus elementos constituintes. É calculado da seguinte forma:
- O lítio (Li) tem massa molar de aproximadamente 6,94 g/mol.
- O alumínio (Al) tem massa molar de aproximadamente 26,98 g/mol.
- O hidrogênio (H) tem massa molar de aproximadamente 1,01 g/mol.
Somando esses valores, a massa molar do LiAlH4 é de aproximadamente 37,95 g/mol.
Hidreto de alumínio e lítio (LiAlH4) Ponto de ebulição
O tetrahidridoaluminato de lítio (LiAlH4) não possui um ponto de ebulição distinto porque se decompõe antes de atingir o ponto de ebulição de qualquer um de seus componentes individuais. Após aquecimento, o LiAlH4 sofre uma reação de decomposição, liberando gás hidrogênio.
Hidreto de alumínio e lítio (LiAlH4) Ponto de fusão
O tetrahidridoaluminato de lítio (LiAlH4) tem um ponto de fusão relativamente baixo. Ele derrete em torno de 150-160°C (302-320°F). Nessa temperatura, o LiAlH4 sólido se transforma em estado líquido, permitindo-lhe participar de reações químicas.
Densidade de hidreto de alumínio e lítio (LiAlH4) g/mL
A densidade do tetrahidridoaluminato de lítio (LiAlH4) é de aproximadamente 0,917 g/mL. Este valor de densidade indica a massa de LiAlH4 presente em um volume específico, com unidade de gramas por mililitro.
Hidreto de alumínio e lítio (LiAlH4) Peso molecular
O peso molecular do tetrahidridoaluminato de lítio (LiAlH4) é calculado somando os pesos atômicos de todos os seus elementos constituintes. O peso molecular do LiAlH4 é de aproximadamente 37,95 g/mol.
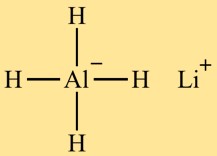
Estrutura do hidreto de alumínio e lítio (LiAlH4)
O tetrahidridoaluminato de lítio (LiAlH4) possui uma estrutura tetraédrica. O átomo de alumínio está no centro, rodeado por quatro átomos de hidrogênio. O átomo de lítio também está ligado ao átomo de alumínio, completando a estrutura.
Solubilidade do hidreto de alumínio e lítio (LiAlH4)
O tetrahidridoaluminato de lítio (LiAlH4) é insolúvel na maioria dos solventes orgânicos, como éteres e hidrocarbonetos. No entanto, é muito reativo com a água, sofrendo uma reação exotérmica vigorosa e produzindo gás hidrogênio. Portanto, o LiAlH4 é geralmente manuseado e armazenado sob condições anidras para evitar qualquer reação adversa com a umidade.
| Aparência | pó branco |
| Gravidade Específica | 0,917g/mL |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 37,95 g/mol |
| Densidade | 0,917g/mL |
| Ponto de fusão | 150-160°C |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage vigorosamente com água |
| Solubilidade | Insolúvel em solventes orgânicos, como éteres e hidrocarbonetos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do hidreto de alumínio e lítio (LiAlH4)
O tetrahidridoaluminato de lítio (LiAlH4) apresenta riscos de segurança significativos e deve ser manuseado com extremo cuidado. É um composto altamente reativo que reage violentamente com a água, liberando gás hidrogênio inflamável. LiAlH4 é pirofórico, o que significa que pode inflamar-se espontaneamente no ar. Deve ser armazenado longe da umidade e armazenado em recipientes bem fechados. O contato direto com LiAlH4 pode causar queimaduras graves e irritação na pele, olhos e sistema respiratório. A inalação de poeira ou vapores pode causar dificuldade respiratória. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao trabalhar com LiAlH4, e só devem ser manuseados em áreas bem ventiladas e com medidas de segurança adequadas em vigor.
| Símbolos de perigo | F, C |
| Descrição de segurança | Altamente inflamável. Reage violentamente com água. Manuseie com extremo cuidado. |
| Números de identificação da ONU | ONU 1410 |
| Código SH | 2850.00.00 |
| Classe de perigo | 4.3 |
| Grupo de embalagem | EU |
| Toxicidade | Muito tóxico, pode causar queimaduras graves e dificuldade respiratória. |
Nota: Os símbolos de perigo utilizados são “F” para inflamável e “C” para corrosivo. A descrição segurança destaca a reatividade com a água e enfatiza a necessidade de extremo cuidado. Os identificadores da ONU e o código HS são códigos de identificação específicos utilizados para fins de transporte e comércio. A classe de perigo indica a classificação da substância com base nas suas características. O grupo de embalagem representa o nível de perigo durante o transporte. O tetraidridoaluminato de lítio (LiAlH4) é altamente tóxico e pode causar queimaduras graves e dificuldade respiratória por contato ou inalação.
Métodos para a síntese de hidreto de alumínio e lítio (LiAlH4)
Diferentes métodos permitem a síntese de tetraidridoaluminato de lítio (LiAlH4).
Um método comum para sintetizar tetrahidridoaluminato de lítio (LiAlH4) é aquecer AlCl3 e combiná-lo com hidreto de lítio (LiH) em um solvente como éter dietílico . A reação ocorre na presença de calor, resultando na formação de LiAlH4.
Outro método é misturar alumínio metálico em pó com hidreto de lítio e depois aquecer a mistura. A reação ocorre levando à formação de LiAlH4.
Para sintetizar LiAlH4 usando uma abordagem diferente, combine deutereto de alumínio e lítio (LiAlD4) com LiH em um solvente como o tetrahidrofurano (THF) . Aquecer a mistura, causando uma reação entre LiAlD4 e hidreto de lítio, resultando na formação de LiAlH4.
Deve-se notar que estes métodos sintéticos requerem um manuseio cuidadoso devido à reatividade dos compostos envolvidos. Precauções como trabalhar em condições inertes, utilizar equipamentos de segurança adequados e realizar reações em áreas bem ventiladas são essenciais para garantir uma síntese segura e bem-sucedida.
Usos de hidreto de alumínio e lítio (LiAlH4)
O tetraidridoaluminato de lítio (LiAlH4) tem diversas aplicações em química orgânica devido às suas poderosas propriedades redutoras. Aqui estão alguns usos comuns:
- Redução de compostos carbonílicos: LiAlH4 converte significativamente vários compostos carbonílicos, como aldeídos, cetonas, ésteres e ácidos carboxílicos, em seus álcoois correspondentes. Esta reação de redução é crucial na síntese de produtos farmacêuticos, química fina e intermediários orgânicos.
- Redução de compostos nitro: LiAlH4 pode reduzir compostos nitro a aminas primárias. Esta transformação é valiosa na síntese de uma ampla gama de compostos orgânicos, incluindo produtos farmacêuticos, corantes e agroquímicos.
- Desoxigenação: LiAlH4 pode remover seletivamente átomos de oxigênio de vários grupos funcionais, como álcoois, ácidos e oximas. Este processo de desoxigenação é útil na preparação de compostos sensíveis ao oxigênio ou quando a funcionalidade do oxigênio precisa ser removida.
- Reações de polimerização: O LiAlH4 atua como agente redutor em determinadas reações de polimerização, facilitando a formação de polímeros. Os pesquisadores usam LiAlH4 na produção de materiais de alto desempenho, incluindo polímeros condutores e plásticos especiais.
- Aplicações Sintéticas: LiAlH4 é usado na síntese de vários compostos orgânicos, incluindo hidrazinas, fosfinas e compostos organometálicos. Esses compostos são essenciais na pesquisa farmacêutica, catálise e ciência dos materiais.
- Agente Redutor de Laboratório: LiAlH4 serve como um agente redutor versátil em laboratório. Permite que os químicos reduzam seletivamente grupos funcionais específicos, permitindo assim a síntese de moléculas complexas com alta precisão.
No geral, o tetrahidridoaluminato de lítio (LiAlH4) desempenha um papel crucial na síntese orgânica, fornecendo aos químicos uma ferramenta poderosa para diversas reações de redução e permitindo a preparação de uma ampla gama de compostos valiosos.
Questões:
P: O hidreto de alumínio e lítio reduz as ligações duplas?
R: Sim, o tetrahidridoaluminato de lítio pode reduzir ligações duplas e convertê-las em ligações simples.
P: Que gás o hidreto de alumínio e lítio libera quando reage com um solvente prótico?
R: Quando o tetraidridoaluminato de lítio reage com um solvente prótico, ele libera gás hidrogênio.
P: Onde posso comprar hidreto de alumínio e lítio?
R: O tetraidridoaluminato de lítio pode ser adquirido de fornecedores de produtos químicos ou fornecedores especializados de equipamentos de laboratório.
P: O hidreto de alumínio e lítio é baseado?
R: Não, o tetraidridoaluminato de lítio não é considerado uma base, mas um poderoso agente redutor.
P: O que o LiAlH4 reduz?
R: O tetrahidridoaluminato de lítio pode reduzir vários grupos funcionais, incluindo compostos carbonílicos, grupos nitro e álcoois.
P: O hidreto de alumínio e lítio é um nucleófilo?
R: Sim, o tetraidridoaluminato de lítio atua como nucleófilo em muitas reações orgânicas devido à presença do íon hidreto.
P: O hidreto de alumínio e lítio reduz os álcoois?
R: Sim, o tetrahidridoaluminato de lítio pode reduzir álcoois para produzir álcoois primários ou secundários.
P: O hidreto de alumínio e lítio reduz os alcenos?
R: Não, o tetrahidridoaluminato de lítio geralmente não reage com alcenos.
P: Com qual dos seguintes solventes o hidreto de alumínio e lítio não reagirá?
R: O tetra-hidridoaluminato de lítio geralmente não reage com solventes apolares, como hexano ou éter dietílico.
P: O hidreto de alumínio e lítio afeta os álcoois?
R: Sim, o tetrahidridoaluminato de lítio pode reduzir álcoois, mas deve ser usado com cautela, pois pode ser muito reativo e potencialmente perigoso.
