O carboneto de cálcio é um composto químico com a fórmula CaC2. É usado principalmente para produzir gás acetileno e cianamida cálcica. Ele reage com a água para produzir gás acetileno e hidróxido de cálcio. As pessoas o usam para soldagem e iluminação.
| Nome da IUPAC | Etinodieto de cálcio |
| Fórmula molecular | CaC2 |
| Número CAS | 75-20-7 |
| Sinônimos | Acetileto de cálcio, percarbono de cálcio, dicarbeto de cálcio, carburo de cálcio, carburo cálcico, etinodieto de cálcio |
| InChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Propriedades do carboneto de cálcio
Fórmula de carboneto de cálcio
A fórmula química do carboneto de cálcio é CaC2. Isto significa que uma molécula de carboneto de cálcio consiste em um átomo de cálcio e dois átomos de carbono. A fórmula mostra a proporção dos elementos do composto.
Massa molar de carboneto de cálcio
A massa molar do CaC2 é 64,099 g/mol. Isso significa que um mol de CaC2 tem massa de 64.099 gramas. A massa molar é calculada adicionando as massas atômicas dos elementos na fórmula. A massa atômica do cálcio é 40,078 g/mol e a do carbono é 12,011 g/mol.
Ponto de ebulição do carboneto de cálcio
O ponto de ebulição do CaC2 é 2300°C. Isto significa que o CaC2 muda de líquido para gasoso nesta temperatura. O ponto de ebulição é influenciado pelas forças intermoleculares e pela pressão atmosférica. O CaC2 possui ligações iônicas fortes que requerem muita energia para serem quebradas.
Ponto de fusão do carboneto de cálcio
O ponto de fusão do CaC2 é 2160°C. Isto significa que o CaC2 muda de sólido para líquido nesta temperatura. O ponto de fusão também é influenciado pelas forças intermoleculares e pela pressão atmosférica. CaC2 tem um alto ponto de fusão devido às suas fortes ligações iônicas.
Densidade de carboneto de cálcio g/ml
A densidade do CaC2 é 2,22 g/ml. Isso significa que um mililitro de CaC2 tem massa de 2,22 gramas. A densidade é calculada dividindo a massa pelo volume. A densidade depende da configuração e disposição dos átomos ou moléculas da substância. CaC2 tem uma alta densidade porque seus átomos estão firmemente agrupados em uma estrutura cristalina.
Peso molecular do carboneto de cálcio
O peso molecular do CaC2 é 64.099 amu (unidades de massa atômica). Isso significa que uma molécula de CaC2 tem massa de 64.099 u. O peso molecular é calculado multiplicando as massas atômicas dos elementos da fórmula pelo seu respectivo número de átomos. A massa atômica do cálcio é 40,078 amu e a do carbono é 12,011 amu.
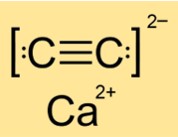
Estrutura de carboneto de cálcio
A estrutura do CaC2 é tetragonal, monoclínica ou monoclínica dependendo da fase (I, II ou III). Isto significa que o CaC2 tem diferentes formas e arranjos de seus átomos ou moléculas em diferentes estados ou condições. A estrutura é determinada pela simetria e geometria da substância. O CaC2 possui estrutura tetragonal na fase I, estrutura monoclínica na fase II e outra estrutura monoclínica na fase III.
Solubilidade do carboneto de cálcio
A solubilidade do CaC2 é uma hidrólise rápida em água. Isto significa que o CaC2 reage rapidamente com a água e forma gás acetileno e hidróxido de cálcio como produtos. A solubilidade é medida pela quantidade de substância que pode se dissolver em um determinado solvente a uma determinada temperatura e pressão. A solubilidade depende da natureza e polaridade da substância e do solvente, bem como de outros fatores como pH e salinidade.
| Aparência | Pó branco com cristais cinza/pretos ou sólido cristalino incolor 3 |
| Densidade específica | 2.22 |
| Cor | Incolor (puro) ou cinza/marrom (qualidade técnica) |
| Cheiro | Inodoro (puro) ou semelhante a alho (grau técnico) |
| Massa molar | 64.099 g/mol |
| Densidade | 2,22g/cm3 |
| Ponto de fusão | 2160°C |
| Ponto de ebulição | 2300ºC |
| Ponto flash | 305°C (acetileno) |
| Solubilidade em Água | Hidrólise rápida |
| Solubilidade | Insolúvel em etanol e éter |
| Pressão de vapor | Insignificante |
| Densidade do vapor | 2,21 (acetileno) |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do carboneto de cálcio
CaC2 é um produto químico inflamável e perigoso. Pode causar riscos de incêndio e explosão quando entra em contato com água ou umidade. Libera gás acetileno, que também é inflamável e explosivo. CaC2 também pode prejudicar sua saúde. Isso pode irritar a pele, os olhos e os pulmões. Isso pode causar erupção na pele, lesões oculares, tosse e falta de ar. Também pode causar acúmulo de líquido nos pulmões se você inalar uma grande quantidade. Você deve evitar o contato com CaC2 e usar equipamento de proteção ao manuseá-lo. Você também deve armazená-lo em um recipiente fechado e seco, longe de qualquer fonte de ignição.
| Símbolos de perigo | F (altamente inflamável), C (corrosivo), W (reage com água) |
| Descrição de segurança | S2 (manter fora do alcance das crianças), S7/8 (manter o recipiente bem fechado e seco), S16 (manter longe de fontes de ignição), S26 (em caso de contato com os olhos, lavar imediata e abundantemente com água e consultar um médico). aconselhamento), S36/37/39 (use roupas de proteção adequadas, luvas e proteção para os olhos/face), S43 (em caso de incêndio, use areia seca ou pó químico seco), S45 (em caso de acidente ou desconforto, procure aconselhamento médico imediatamente) |
| Números de identificação da ONU | ONU 1402 |
| Código SH | 28491000 |
| Classe de perigo | 4.3 |
| Grupo de embalagem | EU |
| Toxicidade | Rato LD50 oral: 80 mg/kg, rato por inalação LC50: 1000 ppm/4h |
Métodos de síntese de carboneto de cálcio
Existem diferentes métodos para sintetizar CaC2 a partir de fontes de cálcio e óxido de carbono.
Um dos métodos mais comuns é o método do forno elétrico a arco. Neste processo, um arco elétrico aquece uma mistura de cal e coque a cerca de 2.200°C. A reação é endotérmica e produz CaC2 fundido e monóxido de carbono. Após a fusão, o CaC2 esfria e as pessoas o trituram em pedaços ou pó, dependendo do uso pretendido. Este método apresenta alto consumo de energia e custo de equipamento.
Outro método é o método do estado sólido. Para realizar este método, aqueça uma mistura de óxido de cálcio e biocarvão ou carvão derivado de biomassa em um forno a aproximadamente 1.750°C. A reação é sólido-sólido e produz CaC2 sólido e monóxido de carbono. Você pode usar diretamente ou processar posteriormente o sólido CaC2. Este método apresenta menor consumo de energia e custo de equipamento do que o método do forno elétrico a arco.
Um terceiro método é o método de substituição da qualidade energética do coque de carvão. Para realizar o processo, misturam-se carvão de baixa qualidade e cal , formam-se pellets e depois pirolisam-se em forno a 1000°C. O gás produzido gera eletricidade e os pellets quentes são transferidos para um forno de CaC2 a 2.000°C. A reação é sólido-sólido e produz CaC2 fundido e monóxido de carbono. Após o resfriamento, o CaC2 fundido é triturado para formar grumos ou pó. Este método apresenta maior eficiência energética e utilização de recursos do que o método do forno elétrico a arco.
Usos do carboneto de cálcio
- Quando o CaC2 reage com a água, produz gás acetileno e hidróxido de cálcio. O gás acetileno é um intermediário importante para a síntese de muitos produtos químicos e polímeros orgânicos, como cloreto de polivinila, acetato de vinila, 1,4-butanodiol, etc. O hidróxido de cálcio é um composto versátil com múltiplas utilizações.
- Para produzir cianamida cálcica, os humanos reagem o CaC2 com o nitrogênio em altas temperaturas. A cianamida cálcica atua como fertilizante nitrogenado, herbicida e desfolhante.
- Para reduzir o teor de enxofre do ferro, ferro fundido, ferro fundido e aço, é utilizado CaC2. Este composto químico reage com o enxofre para formar sulfeto de cálcio, dessulfurando efetivamente o metal. Este processo melhora a qualidade e ductilidade dos produtos siderúrgicos.
- As lâmpadas de metal duro utilizam CaC2 para produzir gás acetileno que, quando queimado, gera luz. Essas lâmpadas eram populares nas indústrias de mineração, espeleologia, ciclismo e automobilística antes que as lâmpadas elétricas se tornassem comuns.
- As pessoas usam CaC2 como agente de amadurecimento em frutas como banana, manga e mamão. Libera gás etileno, que acelera o amadurecimento e realça a cor e a doçura da fruta. Muitos países consideram ilegal e prejudicial a prática de utilização de resíduos de CaC2 para amadurecer frutas devido aos riscos à saúde associados.
- As pessoas usam CaC2 em canhões de bambu e canhões big bang para fazer barulho. Quando misturado com água produz gás acetileno que se inflama para criar uma experiência divertida e festiva para todos.
- Também usado como desoxidante na siderurgia. Remove o oxigênio do aço fundido e evita a formação de óxidos que podem afetar a qualidade dos produtos siderúrgicos.
Questões:
P: Onde comprar carboneto de cálcio localmente?
R: Você pode encontrar pequenas quantidades de CaC2 em sua área em algumas lojas de ferragens ou materiais de soldagem. No entanto, se você precisar de grandes quantidades de CaC2, talvez seja melhor importá-lo diretamente dos fabricantes. Você pode entrar em contato com alguns fornecedores online.
P: Como remover o carboneto de cálcio?
R: CaC2 é um resíduo perigoso e deve ser descartado de maneira adequada. Não se deve jogá-lo no lixo ou no ralo, pois pode reagir com a água e produzir gás acetileno, que é inflamável e explosivo. Você deve entrar em contato com a autoridade local de resíduos perigosos ou com uma empresa licenciada de eliminação de resíduos para obter orientação sobre como descartar o CaC2 com segurança. Pode ser necessário neutralizar com água em área bem ventilada e depois embalar em recipiente lacrado para transporte.
P: O que se forma quando o carboneto de cálcio reage com água pesada?
R: Água pesada é água que contém deutério em vez de hidrogênio. O deutério é um isótopo de hidrogênio que possui um próton e um nêutron em seu núcleo. Quando o CaC2 reage com água pesada, forma hidróxido de cálcio e acetileno deuterado. Acetileno deuterado é acetileno que contém deutério em vez de hidrogênio. A equação química para esta reação é:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
P: O carboneto de cálcio é perigoso?
R: Sim, o CaC2 é perigoso e deve ser manuseado com cuidado. Pode causar risco de incêndio e explosão ao entrar em contato com água ou umidade, pois libera gás acetileno, que também é inflamável e explosivo. Também pode prejudicar a saúde porque pode irritar a pele, os olhos e os pulmões. O CaC2 pode causar erupções cutâneas, lesões oculares, tosse e falta de ar. Também pode causar acúmulo de líquido nos pulmões se você inalar uma grande quantidade. Você deve evitar o contato com CaC2 e usar equipamento de proteção ao manuseá-lo. Você também deve armazená-lo em um recipiente fechado e seco, longe de qualquer fonte de ignição.
P: O carboneto de cálcio é iônico ou covalente?
R: CaC2 é um composto iônico. É composto de íons cálcio (Ca2+) e íons carboneto (C22-). Os compostos iônicos se formam quando átomos metálicos perdem elétrons e átomos não metálicos ganham elétrons para atingir configurações eletrônicas estáveis. Os íons resultantes são mantidos juntos por forças eletrostáticas de atração. O CaC2 possui ligações iônicas fortes que requerem muita energia para serem quebradas.
P: Como é feito o carboneto de cálcio?
R: O CaC2 é obtido aquecendo uma mistura de cal (óxido de cálcio) e coque (carbono) a aproximadamente 2.200°C em um forno elétrico a arco. A reação é endotérmica e produz CaC2 fundido e monóxido de carbono. O CaC2 fundido é então resfriado e moído em pedaços ou pó. Este método apresenta alto consumo de energia e custo de equipamento. Existem também outros métodos que utilizam diferentes fontes de carbono, como biochar ou carvão de baixa classificação, e diferentes métodos de aquecimento, como aquecimento de estado sólido ou aquecimento por indução. Esses métodos podem ter menor consumo de energia e custo de equipamento do que o método do forno elétrico a arco.
P: Posso transformar carbonato de cálcio em carboneto de cálcio?
R: Não, você não pode transformar diretamente o carbonato de cálcio em CaC2. O carbonato de cálcio é um composto estável que não reage com o carbono em altas temperaturas. O carbonato de cálcio deve primeiro ser convertido em óxido de cálcio aquecendo-o fortemente na ausência de ar (calcinação). Então você pode reagir o óxido de cálcio com o carbono em altas temperaturas para produzir CaC2 (carburação). A equação química geral para este processo é:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
P: O que é verdade para a seguinte reação? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
A: As seguintes afirmações são verdadeiras para a reação:
- É uma reação sintética na qual dois ou mais elementos se combinam para formar um composto.
- Esta é uma reação exotérmica, onde o calor é liberado para o meio ambiente.
- Esta é uma reação redox, onde o cálcio é oxidado e o carbono é reduzido.
- Esta é a reação reversa da formação de CaC2 a partir de óxido de cálcio e carbono.
P: Qual é o calor padrão de formação de cac2(s)?
R: O calor padrão de formação de cac2(s) é a variação de entalpia quando um mol de CaC2 é formado a partir de seus elementos em seus estados padrão a 25°C e 1 atm. Pode ser calculado a partir das equações termoquímicas fornecidas usando a lei de Hess. A equação geral para a formação de CaC2 é:
Ca(s) + 2C(s) -> CaC2(s)
Usando a lei de Hess, podemos escrever:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Portanto, o calor padrão de formação de cac2(s) é -680,10 kJ/mol.
P: Quantos gramas de cac2 seriam necessários para gerar 0,35 moles de hcch(g)?
R: Para responder a esta pergunta, precisamos usar a equação balanceada para a reação entre CaC2 e água:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
A partir desta equação podemos ver que um mol de cac2 produz um mol de hcch (também chamado de acetileno). Portanto, para gerar 0,35 moles de hcch, precisamos de 0,35 moles de cac2. Para converter de moles para gramas, precisamos usar a massa molar de cac2, que é 64,099 g/mol. Multiplicando os mols pela massa molar, obtemos:
0,35 mole x 64,099 g/mol = 22,435 g
Portanto, precisamos de 22,435 gramas de cac2 para gerar 0,35 moles de hcch.
P: Quantos mols de cac2 são necessários para reagir completamente com 49,0 g de água?
R: Para responder a esta pergunta, precisamos usar a equação balanceada para a reação entre o carboneto de cálcio e a água:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
A partir desta equação podemos ver que um mol de cac2 reage com dois mols de h2o. Portanto, para determinar os mols de cac2 necessários, precisamos dividir os mols de h2o por dois. Para converter de gramas em moles, precisamos usar a massa molar da água, que é 18,015 g/mol. Dividindo os gramas pela massa molar, obtemos:
49,0 g / 18,015 g/mol = 2,72 moles
Dividindo isso por dois dá:
2,72 moles / 2 = 1,36 moles
Portanto, precisamos de 1,36 moles de cac2 para reagir completamente com 49,0 g de h2o.
P: Quais são os produtos da reação entre o carboneto de cálcio e a água?
R: Os produtos da reação entre CaC2 e água são o gás acetileno e a solução de hidróxido de cálcio.
