O nitrato de bário (Ba(NO3)2) é um sólido branco. Dissolve-se em água e forma íons de bário e nitrato. Pode explodir quando aquecido ou misturado com combustíveis.
| Nome da IUPAC | Dinitrato de bário |
| Fórmula molecular | Ba(NO3)2 |
| Número CAS | 10022-31-8 |
| Sinônimos | Nitrato de bário, dinitrato de bário, dinitrato de bário, CQ9625000, (nitrooxi) nitrato de bário |
| InChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Propriedades do nitrato de bário
Fórmula de nitrato de bário
A fórmula molecular do nitrato de bário é Ba(NO3)2. Mostra que uma molécula de nitrato de bário consiste em um átomo de bário e duas moléculas de nitrato. O íon nitrato tem carga de -1 e o íon bário tem carga de +2, então eles se combinam em uma proporção de 1:2 para formar um composto neutro.
Massa molar de nitrato de bário
A massa molar do Ba(NO3)2 é 261,337 g/mol. É a massa de um mol de moléculas de Ba(NO3)2. Para calculá-lo, você deve somar as massas atômicas de todos os átomos da fórmula:
Massa molar de Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Ponto de ebulição do nitrato de bário
O ponto de ebulição do Ba(NO3)2 é 83°C. Esta é a temperatura na qual o Ba(NO3)2 passa do estado líquido para o estado gasoso. No entanto, o Ba(NO3)2 decompõe-se antes de atingir o seu ponto de ebulição, pelo que não é possível fervê-lo sem quebrá-lo em outras substâncias.
Ponto de fusão do nitrato de bário
O ponto de fusão do Ba(NO3)2 é 592°C. Esta é a temperatura na qual o Ba(NO3)2 muda de sólido para líquido. Ba(NO3)2 é um sólido cristalino branco à temperatura e pressão ambientes, mas derrete quando aquecido acima do seu ponto de fusão.
Densidade de nitrato de bário g/ml
A densidade do Ba(NO3)2 é 3,23 g/ml. Esta é a massa por unidade de volume de Ba(NO3)2. Para calculá-lo, você deve dividir a massa de uma amostra de Ba(NO3)2 pelo seu volume:
Densidade de Ba(NO3)2 = Massa / Volume
Por exemplo, se tivermos uma amostra de 10 g de Ba(NO3)2 e seu volume for 3,1 ml, então sua densidade será:
Densidade de Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Peso molecular do nitrato de bário
O peso molecular do Ba(NO3)2 é igual à sua massa molar, que é 261,337 g/mol. É a massa de um mol de moléculas de Ba(NO3)2. Às vezes, o termo peso molecular é usado de forma intercambiável com massa molar, mas eles não são exatamente iguais. O peso molecular refere-se à massa média de uma molécula de uma substância, enquanto a massa molar se refere à massa de um mol de uma substância.
Estrutura do nitrato de bário
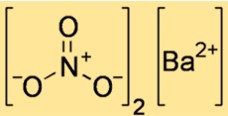
A estrutura do Ba(NO3)2 mostra como os átomos e os íons estão dispostos no espaço. Ba(NO3)2 é um composto iônico, o que significa que é composto de íons de bário com carga positiva e íons de nitrato com carga negativa mantidos juntos por forças eletrostáticas. A estrutura do Ba(NO3)2 pode ser representada por uma célula unitária, que é a menor unidade repetida que mostra o arranjo dos íons em uma rede cristalina.
Uma célula unitária de Ba(NO3)2 tem formato cúbico, com um íon bário em cada canto e um íon nitrato no centro de cada face. O número de coordenação de cada íon é seis, o que significa que cada íon está rodeado por seis íons com cargas opostas. O comprimento de cada borda da célula unitária é 0,65 nm.
Solubilidade do nitrato de bário
Solubilidade de Ba(NO3)2 é a quantidade de Ba(NO3)2 que pode se dissolver em uma determinada quantidade de solvente, geralmente água. A solubilidade depende de vários fatores, como temperatura, pressão e presença de outras substâncias na solução.
A 20°C e à pressão atmosférica, a solubilidade do Ba(NO3)2 em água é de aproximadamente 34 g por 100 ml. Isto significa que 34 g de Ba(NO3)2 podem dissolver-se em 100 ml de água nestas condições. A solubilidade aumenta com o aumento da temperatura e diminui com o aumento da pressão.
Ba(NO3)2 também é solúvel em outros solventes, como etanol, acetona e metanol, mas menos solúvel que em água.
| Aparência | Sólido branco |
| Densidade específica | 3.23 |
| Cor | Incolor, prateado ou cinza |
| Cheiro | Inodoro |
| Massa molar | 261.337 g/mol |
| Densidade | 3,23g/ml |
| Ponto de fusão | 592°C |
| Ponto de ebulição | 83°C |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 34 g por 100 ml a 20°C |
| Solubilidade | Solúvel em etanol, acetona e metanol; insolúvel em éter e clorofórmio |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não disponível |
Segurança e perigos do nitrato de bário
Ba(NO3)2 é uma substância tóxica e oxidante. Pode prejudicá-lo se você engolir ou respirar. Isso pode irritar os olhos, a pele e o sistema respiratório. Ba(NO3)2 também pode causar espasmos musculares, problemas cardíacos e morte. Você deve evitar o contato com Ba(NO3)2 e usar equipamento de proteção ao manuseá-lo. Você também deve mantê-lo longe de calor, faíscas, chamas e materiais combustíveis. Se você for exposto ao Ba(NO3)2, lave os olhos e a pele com água e procure atendimento médico. Você também pode tomar sais de sulfato para reduzir a toxicidade do bário.
| Símbolos de perigo | O (oxidante), Xn (prejudicial) |
| Descrição de segurança | S13: Manter afastado de alimentos e bebidas, inclusive de animais. S17: Manter afastado de materiais combustíveis. S22: Não respirar as poeiras. S26: Em caso de contato com os olhos, lavar imediata e abundantemente com água e consultar um médico. S36/37/39: Use roupas de proteção, luvas e proteção para os olhos/face adequados. |
| Números de identificação da ONU | ONU1446 |
| Código SH | 2834 29 10 |
| Classe de perigo | 5.1 (Materiais oxidantes) |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato) = 355 mg/kg; LC50 (inalação, rato) = 0,15 mg/L/4h |
Métodos para a síntese de nitrato de bário
Diferentes métodos podem ser usados para criar Ba(NO3)2, que é uma substância sólida branca.
Um método envolve a reação do carbonato de bário com ácido nítrico . Isto produz Ba(NO3)2 e dióxido de carbono. Filtre a solução de Ba(NO3)2 para remover quaisquer impurezas de ferro e depois evapore-a para obter cristais sólidos.
Outro método é reagir o sulfeto de bário com ácido nítrico . Isto produz Ba(NO3)2 e sulfeto de hidrogênio. Para purificar e cristalizar a solução de Ba(NO3)2, seguimos o mesmo processo de antes.
Um terceiro método envolve a dissolução do bário metálico ou do óxido de bário em ácido nítrico . Isto produz Ba(NO3)2 e hidrogênio ou água. A solução contendo Ba(NO3)2 é então concentrada e sofre cristalização.
Um quarto método é usar a síntese de sal fundido. Isto envolve o aquecimento de uma mistura de Ba(NO3)2 e um vesicante inorgânico, como cloreto de amônio, bicarbonato de sódio ou nitrito de sódio. O vesicante se decompõe e cria poros nos cristais de Ba(NO3)2. Isso os torna mais confiáveis como oxidantes pirotécnicos.
Aqui estão alguns dos métodos para sintetizar Ba(NO3)2. Todos eles usam ácido nítrico como reagente comum e produzem Ba(NO3)2 como produto.
Usos do nitrato de bário
Alguns dos usos do Ba(NO3)2 são:
- Compostos de óxido de bário – Utilizados na produção de materiais contendo óxido de bário, como cerâmica, vidro e tubos de raios catódicos.
- Chama Verde – Utilizada em semáforos verdes e fogos de artifício porque queima com chama verde devido à emissão de íons de bário.
- Rodenticida – Usado como rodenticida para matar ratos e camundongos, pois é tóxico para eles.
- Oxidante – Utilizado em detonadores e explosivos, é um poderoso oxidante que pode potencializar a combustão de outras substâncias.
- Primer – Utilizado em primers e balas traçadoras porque proporciona ignição e visibilidade da munição.
- Pigmento – Utilizado na fabricação de tintas e pigmentos porque pode dar-lhes a cor branca ou verde.
- Agente Oxidante – Utilizado como agente oxidante em diversas reações químicas, como na síntese de peróxido de bário e hidróxido de bário.
- Explosivos – Utilizados na fabricação de explosivos como o Baratol, que é uma mistura de Ba(NO3)2, TNT e ligante.
Questões:
P: O nitrato de bário é solúvel?
R: Ba(NO3)2 é solúvel em água e alguns outros solventes, como etanol, acetona e metanol.
P: O nitrato de bário é útil para concreto?
R: Ba(NO3)2 não é útil para concreto, pois pode causar corrosão das armaduras de aço e fissuras no concreto.
P: Será formado um precipitado se soluções de sulfato de potássio e nitrato de bário forem combinadas?
R: Sim, um precipitado de sulfato de bário (BaSO4) se formará se soluções de sulfato de potássio (K2SO4) e nitrato de bário (Ba(NO3)2) forem combinadas.
Q: O nitrato de bário tem a fórmula Ba(NO3)2. Qual afirmação é verdadeira sobre o nitrato de bário?
R: Uma afirmação possível é: Ba(NO3)2 é um composto iônico composto por um íon bário e dois íons nitrato.
P: O nitrato de bário é volátil?
R: Não, o Ba(NO3)2 não é volátil, pois tem um alto ponto de fusão e se decompõe antes de ferver.
P: O nitrato de bário é neutro?
R: Não, Ba(NO3)2 não é neutro, pois é um sal ácido que pode diminuir o pH de uma solução.
P: O que é produzido na reação de substituição de Ba(NO3)2 e Na2SO4?
R: NaNO3 e BaSO4 são produzidos durante a reação de substituição de Ba(NO3)2 e Na2SO4.
P: O Ba(NO3)2 é solúvel em água?
R: Sim, Ba(NO3)2 é solúvel em água, pois se dissolve para formar íons de bário e íons nitrato.
P: Qual é a equação iônica líquida para a reação de MgSO4 com Ba(NO3)2?
A: A equação iônica líquida para a reação de MgSO4 com Ba(NO3)2 é:
Ba2+ + SO42- → BaSO4
P: Quantos mols existem em 432 g de Ba(NO3)2?
R: O número de moles em 432 g de Ba(NO3)2 é:
n = m/M, n = 432/261.337, n = 1.653 moles
P: O Ba(NO3)2 é solúvel?
R: Sim, Ba(NO3)2 é solúvel porque se dissolve para formar íons de bário e íons nitrato.
