O sulfato de amônio ((NH4)2SO4) é um fertilizante amplamente utilizado que fornece nutrientes essenciais às plantas. Também é utilizado em retardadores de chama, na purificação de proteínas e como aditivo alimentar.
| Nome da IUPAC | Tetraoxossulfato de amônio (VI) |
| Fórmula molecular | (NH4)2SO4 |
| Número CAS | 7783-20-2 |
| Sinônimos | Sulfato de amônio, sulfato de amônio (2:1), sulfato de diamônio, sal de diamônio de ácido sulfúrico, mascagnita, Actamaster, Dolamin |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Propriedades do sulfato de amônio
Fórmula de sulfato de amônio
A fórmula do sulfato de amônio é (NH4)2SO4. Isso significa que uma molécula de sulfato de amônio contém dois íons de amônio (NH4)+ e um íon sulfato (SO4)2-. Os íons amônio e o íon sulfato são mantidos juntos por ligações iônicas.
Massa molar de sulfato de amônio
A massa molar de (NH4)2SO4 é 132,14 g/mol. Para calcular a massa molar, precisamos somar as massas atômicas de todos os átomos da fórmula. As massas atômicas são:
- Nitrogênio: 14,01 g/mol
- Hidrogênio: 1,01 g/mol
- Enxofre: 32,06 g/mol
- Oxigênio: 16,00 g/mol
Assim, a massa molar de (NH4)2SO4 é:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Ponto de ebulição do sulfato de amônio
O ponto de ebulição do (NH4)2SO4 não está bem definido porque ele se decompõe antes de atingir o ponto de ebulição. Quando aquecido acima de 235°C, (NH4)2SO4 começa a perder água e formar bissulfato de amônio (NH4)HSO4. Quando aquecido acima de 280°C, o bissulfato de amônio se decompõe ainda mais em amônia (NH3) e ácido sulfúrico (H2SO4).
Ponto de fusão de sulfato de amônio
O ponto de fusão do (NH4)2SO4 é 235°C. Esta é a temperatura na qual (NH4)2SO4 muda de sólido para líquido. Porém, como mencionado acima, o (NH4)2SO4 também começa a se decompor nesta temperatura, portanto não é uma fase líquida pura.
Densidade de sulfato de amônio g/ml
A densidade de (NH4)2SO4 é 1,77 g/ml à temperatura e pressão ambientes. Isto significa que um mililitro de (NH4)2SO4 pesa 1,77 gramas. A densidade de uma substância depende da sua temperatura e pressão, por isso pode variar ligeiramente em diferentes condições.
Peso molecular do sulfato de amônio
O peso molecular do (NH4)2SO4 é igual à sua massa molar, que é 132,14 g/mol. Peso molecular é a massa de um mol de uma substância, que é igual a 6,022 x 10 ^ 23 moléculas. O peso molecular também pode ser expresso em unidades de massa atômica (amu), que são iguais a 1/12 da massa de um átomo de carbono-12. Em amu, o peso molecular de (NH4)2SO4 é 132,14 amu.
Estrutura do sulfato de amônio
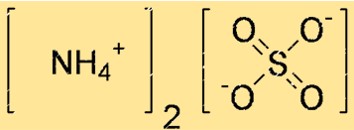
A estrutura de (NH4)2SO4 pode ser representada por uma estrutura de pontos de Lewis ou por um modelo de bola e bastão. Uma estrutura de pontos de Lewis mostra os elétrons de valência de cada átomo e as ligações entre eles. Um modelo de bola e bastão mostra a forma e o tamanho de cada átomo e as ligações entre eles.
Na estrutura acima, as linhas duplas (=) representam ligações duplas, as linhas simples (-) representam ligações simples e os pontos (.) representam pares solitários de elétrons.
Solubilidade do sulfato de amônio
A solubilidade de (NH4)2SO4 é a quantidade de (NH4)2SO4 que pode se dissolver em uma determinada quantidade de água a uma determinada temperatura. A solubilidade do (NH4)2SO4 aumenta com o aumento da temperatura, conforme mostrado nos dados a seguir:
| Temperatura (°C) | Solubilidade (g/100 ml de água) |
| 0 | 70,6 |
| Aparência | Grânulos ou cristais higroscópicos brancos e finos |
| Densidade específica | 1,77 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 132,14 g/mol |
| Densidade | 1,77g/cm3 |
| Ponto de fusão | 235 a 280°C (decompõe-se) |
| Ponto de ebulição | Não aplicável (decomposto) |
| Ponto flash | Não inflamável |
| Solubilidade em Água | 70,6 g por 100 g de água (0°C), 74,4 g por 100 g de água (20°C), 103,8 g por 100 g de água (100°C) |
| Solubilidade | Insolúvel em acetona, álcool e éter |
| Pressão de vapor | Insignificante |
| Densidade do vapor | Não aplicável |
| pKa | 5,5 (para íon amônio) |
| pH | 5 a 6 (para uma solução a 5%) |
Segurança e perigos do sulfato de amônio
(NH4)2SO4 não é muito perigoso para a saúde humana, mas pode causar irritação na pele, olhos, nariz e garganta se contactado ou inalado. Também pode causar náusea, dor de estômago, diarréia, vômito e sonolência se ingerido. É prejudicial à vida aquática e sua liberação no meio ambiente deve ser evitada. Decompõe-se quando aquecido acima de 235°C, formando gases tóxicos como amônia e ácido sulfúrico. É geralmente reconhecido como seguro como aditivo alimentar, mas pode causar reações alérgicas ou sintomas de asma em algumas pessoas.
| Símbolos de perigo | Não é necessário |
| Descrição de segurança | Evite a liberação no meio ambiente. Descarte o conteúdo/recipiente em uma instalação de eliminação de resíduos aprovada. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 31022100 |
| Classe de perigo | Não aplicável |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato) = 2,840 mg/kg |
Métodos para a síntese de sulfato de amônio
(NH4)2SO4 pode ser sintetizado por vários métodos porque é um sal inorgânico. Alguns dos métodos comuns são:
- Neutralização de amônia e ácido sulfúrico: Este método envolve a mistura de gás amônia ou uma solução aquosa com ácido sulfúrico e evaporação da água para obter cristais de (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- Reação de carbonato de amônio e gesso: Este método envolve a adição de gesso finamente dividido ( sulfato de cálcio ) a uma solução de carbonato de amônio e a filtragem do precipitado de carbonato de cálcio.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Subproduto de outros processos: Vários processos industriais, como purificação de gás de coqueria, produção de caprolactama, refino de níquel e dessulfurização de gases de combustão, podem produzir (NH4)2SO4 como subproduto. Esses processos utilizam amônia ou compostos de amônio para remover enxofre ou outras impurezas dos fluxos de gás, resultando em (NH4)2SO4 como resíduo ou produto valioso.
Usos do sulfato de amônio
(NH4)2SO4 é um sal inorgânico que possui diversas utilizações, como:
- Fertilizante alcalino do solo: (NH4)2SO4 reduz o pH do solo e fornece nitrogênio e enxofre para o crescimento das plantas. É adequado para culturas que requerem solos ácidos, como mirtilos, batatas e tomates.
- Adjuvante de pulverização agrícola: (NH4)2SO4 melhora a eficácia de inseticidas, herbicidas e fungicidas solúveis em água, ligando-se a íons de ferro e cálcio que podem interferir em sua ação. Também melhora a absorção de glifosato e outros herbicidas sistêmicos pelas plantas.
- Purificação de proteínas: (NH4)2SO4 pode precipitar proteínas de soluções aquosas, aumentando a força iônica e reduzindo a solubilidade das proteínas. O método salting-out pode ser usado para separar proteínas com base no seu tamanho, carga e hidrofobicidade.
- Aditivo Alimentar: Vários produtos alimentícios como pão, queijo, vinho e vegetais enlatados usam (NH4)2SO4 como regulador de acidez, condicionador de massa, nutriente de levedura e agente firmador. O FDA o reconhece como geralmente seguro.
- Outros usos: (NH4)2SO4 pode ser usado para fazer outros sais de amônio, extintores de incêndio, retardadores de chama, curtimento de couro, tingimento de têxteis, galvanoplastia de metais e química analítica.
Questões:
P: Qual é a fórmula química do sulfato de amônio?
R: A fórmula química do sulfato de amônio é (NH4)2SO4. Isso significa que uma molécula de sulfato de amônio contém dois íons de amônio (NH4)+ e um íon sulfato (SO4)2-.
P: O sulfato de amônio é solúvel?
R: (NH4)2SO4 é solúvel em água, mas insolúvel em acetona, álcool e éter. Pode dissolver 70,6 gramas por 100 gramas de água a 0°C, 74,4 gramas por 100 gramas de água a 20°C e 103,8 gramas por 100 gramas de água a 100°C.
P: Quanto sulfato de amônio por galão de água?
R: A quantidade de (NH4)2SO4 por galão de água depende da concentração desejada e da temperatura da água. Por exemplo, se a concentração desejada for 10% (p/v) e a temperatura da água for 20°C, então a quantidade de (NH4)2SO4 por galão de água é:
10% (p/v) = 10 gramas por 100 ml de água 1 galão = 3.785,41 ml 10 gramas x 3.785,41 ml / 100 ml = 378,54 gramas Portanto, a quantidade de (NH4)2SO4 por galão de água é 378,54 gramas.
P: Ocorre uma reação quando soluções aquosas de sulfato de amônio e cloreto de cálcio são combinadas?
R: Não, nenhuma reação ocorre quando soluções aquosas de (NH4)2SO4 e cloreto de cálcio são combinadas. Na verdade, os dois sais são solúveis em água e não formam nenhum precipitado insolúvel. A solução resultante contém quatro íons: amônio (NH4)+, sulfato (SO4)2-, cálcio (Ca2+) e cloreto (Cl)-.
P: Como precipitar proteínas com sulfato de amônio?
R: Para precipitar proteínas com (NH4)2SO4, podem ser seguidos os seguintes passos:
- Prepare uma solução aquosa de (NH4)2SO4 com concentração e volume conhecidos.
- Adicione a solução de proteína à solução de (NH4)2SO4 lentamente e mexendo.
- Monitore a turbidez ou densidade óptica da mistura para determinar a quantidade de precipitação de proteínas.
- Centrifugar a mistura para separar o pellet de proteína do sobrenadante.
- Descarte o sobrenadante e lave a pelota de proteína com tampão ou água para remover o excesso de sal.
- Ressuspender ou solubilizar o pellet de proteína em um tampão apropriado para posterior análise ou uso.
P: Quantos gramas existem em 6,90 moléculas de sulfato de amônio?
R: Para descobrir quantos gramas existem em 6,90 moléculas de (NH4)2SO4, precisamos usar o número de Avogadro e a massa molar de (NH4)2SO4. O número de Avogadro é 6,022 x 10 ^ 23, o que significa que um mol de qualquer substância contém essa mesma quantidade de moléculas. A massa molar de (NH4)2SO4 é 132,14 g/mol, o que significa que um mol de (NH4)2SO4 pesa essa mesma quantidade de gramas. Portanto, podemos usar esta fórmula para calcular quantos gramas existem em 6,90 moléculas de (NH4)2SO4:
gramas = moléculas x massa molar / número de Avogadro gramas = 6,90 x 132,14 / 6,022 x 10 ^ 23 gramas = 1,52 x 10 ^ -21 Portanto, há 1,52 x 10 ^ -21 gramas em 6,90 moléculas de (NH4) 2SO4.
P: Quanto enxofre existe no sulfato de amônio?
R: (NH4)2SO4 contém 24% de enxofre em massa. Isto pode ser calculado usando a fórmula da composição percentual e as massas molares de enxofre e (NH4)2SO4. A massa molar do enxofre é 32,06 g/mol e a massa molar do (NH4)2SO4 é 132,14 g/mol. Portanto, a porcentagem de enxofre em (NH4)2SO4 é:
porcentagem = massa molar de enxofre x 100 / massa molar de sulfato de amônio porcentagem = 32,06 x 100 / 132,14 porcentagem = 24,26%
P: Qual destes sais é um sal neutro? na2so4 nacn kf (nh4)2so4
R: Um sal neutro é aquele que não afeta o pH da solução quando dissolvido em água. É formado pela reação de um ácido forte e uma base forte. Dos quatro sais fornecidos, apenas o na2so4 é um sal neutro. É formado pela reação do hidróxido de sódio (uma base forte) e do ácido sulfúrico (um ácido forte). Outros sais são ácidos ou básicos. Nacn é um sal básico, formado pela reação do hidróxido de sódio (uma base forte) e do ácido cianídrico (um ácido fraco). Kf é um sal básico, formado pela reação do hidróxido de potássio (uma base forte) e do ácido fluorídrico (um ácido fraco). (Nh4)2so4 é um sal ácido, formado pela reação de hidróxido de amônio (uma base fraca) e ácido sulfúrico (um ácido forte).
P: Qual é a massa molar de (nh4)2so4?
R: A massa molar de (nh4)2so4 é 132,14 g/mol. Para encontrar a massa molar, precisamos somar as massas atômicas de todos os átomos da fórmula. As massas atômicas são:
- Nitrogênio: 14,01 g/mol
- Hidrogênio: 1,01 g/mol
- Enxofre: 32,06 g/mol
- Oxigênio: 16,00 g/mol
Assim, a massa molar de (nh4)2so4 é:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
P: O (nh4)2so4 é solúvel em água?
R: Sim, (nh4)2so4 é solúvel em água. Pode dissolver até 70,6 gramas por 100 gramas de água a 0°C, 74,4 gramas por 100 gramas de água a 20°C e 103,8 gramas por 100 gramas de água a 100°C.
