Dietilamina (DEA) é um composto químico que possui um forte odor semelhante ao da amônia. É utilizado na produção de pesticidas, produtos farmacêuticos e aceleradores de borracha. Isto pode causar irritação na pele, olhos e sistema respiratório.
| Nome IUPAC | N,N-dietilmetanamina |
| Fórmula molecular | C4H11N |
| Número CAS | 109-89-7 |
| Sinônimos | N-etil-etanamina, DEA, dietilamina, N,N-dietilamina, N-etiletanamina, dietilamina |
Propriedades da dietilamina
Fórmula Dietilamina
A fórmula da dietilamina é C4H11N. É uma amina alifática primária com dois grupos etil ligados ao átomo de nitrogênio. A estrutura molecular da dietilamina contém um átomo central de nitrogênio ligado a dois grupos etil e um átomo de hidrogênio.
Massa molar de dietilamina
A massa molar do DEA é 73,14 g/mol. Isto é calculado adicionando as massas atômicas de todos os átomos presentes em uma molécula de DEA. A massa molar é um parâmetro importante usado para calcular a quantidade de DEA necessária para uma determinada reação química.
Ponto de ebulição da dietilamina
O ponto de ebulição do DEA é 55,8°C. Isto significa que a esta temperatura, a forma líquida do DEA começará a vaporizar e a transformar-se em gás. O ponto de ebulição é um parâmetro importante que determina as condições necessárias para que uma reação química ocorra.
Ponto de fusão da dietilamina
O ponto de fusão do DEA é -49,8°C. Isto significa que a esta temperatura, a forma sólida do DEA começará a derreter e a se transformar em líquido. O ponto de fusão é um parâmetro importante usado para determinar a pureza do DEA.
Densidade de dietilamina g/mL
A densidade do DEA é 0,707 g/mL. Isto significa que um mililitro de DEA pesa 0,707 gramas. A densidade é um parâmetro importante usado para calcular a quantidade de DEA necessária para uma determinada reação química.
Peso molecular da dietilamina
O peso molecular do DEA é 73,14 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula de DEA. O peso molecular é um parâmetro importante usado para calcular a quantidade de DEA necessária para uma determinada reação química.
Estrutura da dietilamina
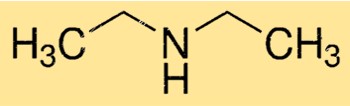
DEA tem uma estrutura molecular linear, com o átomo central de nitrogênio ligado a dois grupos etil e um átomo de hidrogênio. A molécula tem uma forma de pirâmide trigonal devido ao par de elétrons solitários no átomo de nitrogênio. Esta estrutura é importante na determinação da reatividade e das propriedades do DEA.
Solubilidade da dietilamina
DEA é solúvel em água e em muitos solventes orgânicos. Seu pKa é 10,75, o que significa que é uma base fraca. A solubilidade do DEA depende de fatores como temperatura, pH e polaridade do solvente. Sua solubilidade em água é de 100 g/L a 25°C.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,707g/ml |
| Cor | Incolor |
| Cheiro | Semelhante à amônia |
| Massa molar | 73,14 g/mol |
| Densidade | 0,707g/ml |
| Ponto de fusão | -49,8ºC |
| Ponto de ebulição | 55,8ºC |
| Ponto flash | -15ºC |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em muitos solventes orgânicos |
| Pressão de vapor | 94,7 mmHg a 25°C |
| Densidade do vapor | 2,5 |
| pKa | 10h75 |
| pH | Básico |
Segurança e perigos da dietilamina
DEA pode ser perigoso para a saúde humana se não for manuseado adequadamente. É corrosivo e pode causar irritação na pele, olhos e trato respiratório em contato. A exposição prolongada à DEA pode causar danos ao fígado e aos rins. É inflamável e pode formar misturas explosivas com o ar. Precauções especiais, como ventilação adequada, equipamento de proteção individual e recipientes de armazenamento resistentes ao fogo, devem ser tomadas ao manusear o DEA. Em caso de exposição acidental, deve-se procurar atendimento médico imediato. É importante seguir todas as diretrizes e protocolos de segurança ao trabalhar com a DEA para manter você e outras pessoas seguras.
| Símbolos de perigo | Corrosivo, Inflamável |
| Descrição de segurança | Manter afastado do calor, faíscas, chamas abertas e superfícies quentes. Evite respirar vapores, névoas ou gases. Use luvas de proteção, proteção para os olhos e proteção facial. Usar em uma área bem ventilada. |
| Números de identificação da ONU | ONU 1154 |
| Código SH | 29211990 |
| Classe de perigo | 3 |
| Grupo de embalagem | II |
| Toxicidade | Pode causar irritação na pele, olhos e trato respiratório. A exposição prolongada pode causar danos ao fígado e aos rins. |
Métodos para a síntese de dietilamina
Existem vários métodos para sintetizar DEA, incluindo a reação de etanol e amônia ou a reação de dietil sulfato e amônia.
Um método envolve o aquecimento de uma mistura de etanol e amônia na presença de um catalisador, como alumina ou sílica gel. A reação produz DEA e água, que podem ser separados por destilação.
Outro método envolve a reação de dietil sulfato com amônia . A reação ocorre em um solvente, como metanol ou etanol, e produz sulfato de DEA. Para produzir DEA e sulfato de sódio, o sulfato de DEA pode ser tratado com uma base forte, como o hidróxido de sódio.
Para sintetizar DEA, o etileno pode reagir com amônia na presença de um catalisador, como o óxido de ferro. A reação produz uma mistura de DEA e trietilamina, que pode ser separada por destilação.
Ao sintetizar DEA, deve-se ter cautela, pois os reagentes e produtos podem representar riscos à saúde humana e ao meio ambiente. Portanto, é necessário utilizar medidas e equipamentos de segurança adequados durante o processo de síntese.
Usos da dietilamina
DEA tem diversos usos em diferentes indústrias devido às suas propriedades únicas. Aqui estão alguns de seus usos comuns:
- Produtos farmacêuticos: Usados como alicerce na síntese de produtos farmacêuticos, como anestésicos locais e anti-histamínicos.
- Químicos agrícolas: utilizados como matéria-prima na produção de herbicidas, como o glifosato.
- Indústria da borracha: Utilizada na produção de aceleradores para vulcanização de borracha.
- Indústria de corantes: utilizada na produção de corantes e pigmentos, como corantes ácidos e corantes reativos.
- Inibidores de corrosão: Usados como inibidores de corrosão na indústria petrolífera para proteger tubulações e tanques de armazenamento contra corrosão.
- Solventes: Utilizados como solvente na produção de resinas e polímeros sintéticos.
- Síntese química: Também usado como reagente em uma ampla gama de reações de síntese química.
Questões:
P: Qual é mais básico, trietilamina ou dietilamina?
R: A trietilamina é mais básica que a DEA devido ao seu tamanho maior e à presença de três grupos etil que ajudam a aumentar a densidade eletrônica.
P: Qual é o pH da dietilamina 0,10 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
R: O pH de uma solução DEA 0,10 M pode ser calculado usando o valor Kb e a equação da constante de dissociação de base. O pH da solução é aproximadamente 10,49.
P: Qual é o pH da dietilamina 0,11 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
R: O pH de uma solução DEA 0,11 M pode ser calculado usando o valor Kb e a equação da constante de dissociação de base. O pH da solução é aproximadamente 10,50.
P: Qual é a entalpia padrão de formação de dietilamina líquida, (CH3CH2)2NH?
R: A entalpia padrão de formação de DEA líquido é -42,52 kJ/mol.
P: A dietilamina é polar?
R: Sim, DEA é polar devido à presença de um átomo de nitrogênio com um par de elétrons solitários e à diferença de eletronegatividade entre nitrogênio e carbono.
P: Qual é mais básico, dietilamina ou trietilamina?
R: A trietilamina é mais básica que a DEA devido à presença de três grupos etil que ajudam a aumentar a densidade eletrônica.
P: Qual é o pH de uma solução de dietilamina 0,10 M?
R: O pH de uma solução DEA 0,10 M pode ser calculado usando o valor Kb e a equação da constante de dissociação de base. O pH da solução é aproximadamente 10,49.
P: A dietilamina é um ácido forte ou fraco?
R: DEA é uma base fraca, não um ácido forte. Ele reage com a água para produzir íons hidróxido e íons dietilamônio.
