Tetracloroetileno (C2Cl4) é um líquido incolor e não inflamável comumente usado em lavagem a seco. Pode causar problemas de saúde como tonturas, dores de cabeça e danos ao fígado se ingerido ou inalado excessivamente.
| Nome IUPAC | Tetracloroeteno |
| Fórmula molecular | C2Cl4 |
| Número CAS | 127-18-4 |
| Sinônimos | Percloroetileno, PCE, tetracloroeteno, dímero de tetracloreto de carbono, 1,1,2,2-tetracloroetileno |
| InChI | InChI=1S/C2Cl4/c3-1(4)2(5)6 |
Propriedades do tetracloroetileno
Fórmula de tetracloroetileno
O tetracloroetileno, também conhecido como percloroetileno ou PCE, tem fórmula química C2Cl4. Isto significa que cada molécula de tetracloroetileno é composta por dois átomos de carbono e quatro átomos de cloro. A fórmula é importante porque nos ajuda a compreender a estrutura molecular e as propriedades do tetracloroetileno.
Massa molar de tetracloroetileno
A massa molar de C2Cl4 é 165,83 g/mol. Isso significa que um mol de C2Cl4, que equivale a 6,022 x 10 ^ 23 moléculas, pesa 165,83 gramas. A massa molar é importante em cálculos químicos e pode ajudar a determinar quanto C2Cl4 é necessário para uma reação específica.
Ponto de ebulição do tetracloroetileno
O ponto de ebulição do C2Cl4 é 121,1°C (250°F). Isto significa que a uma temperatura de 121,1°C, o C2Cl4 mudará de líquido para gás. O ponto de ebulição é uma propriedade importante porque afeta o comportamento do C2Cl4 em diferentes ambientes.
Ponto de fusão do tetracloroetileno
O ponto de fusão do C2Cl4 é -22,94°C (-9,31°F). Isso significa que a uma temperatura abaixo de -22,94°C, o C2Cl4 mudará de sólido para líquido. O ponto de fusão é importante na determinação do estado físico do C2Cl4 em diferentes temperaturas.
Densidade de tetracloroetileno g/mL
A densidade do C2Cl4 é 1,62 g/mL à temperatura ambiente. Isso significa que o C2Cl4 é mais denso que a água, que tem densidade de 1 g/mL. A densidade é importante para compreender as propriedades físicas do C2Cl4 e como ele se comporta em diferentes ambientes.
Peso Molecular do Tetracloroetileno
O peso molecular do C2Cl4 é 165,83 g/mol. Isso significa que o peso de uma molécula de C2Cl4 é 165,83 unidades de massa atômica. O peso molecular é importante em cálculos químicos e pode ajudar a determinar a quantidade de C2Cl4 necessária para uma reação específica.
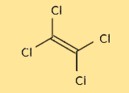
Estrutura do tetracloroetileno
A estrutura do C2Cl4 consiste em dois átomos de carbono e quatro átomos de cloro dispostos em forma tetraédrica. Os átomos de carbono estão unidos por uma ligação dupla, enquanto cada átomo de cloro está ligado a um dos átomos de carbono. A estrutura é importante para a compreensão das propriedades químicas e físicas do C2Cl4.
Solubilidade do tetracloroetileno
C2Cl4 é insolúvel em água, mas é solúvel em solventes orgânicos como álcool e éter. Isto significa que o C2Cl4 não se dissolve na água, mas pode dissolver-se em outras substâncias. A solubilidade é importante para a compreensão do comportamento do C2Cl4 em diferentes ambientes, como em ambientes industriais ou em laboratório.
| Aparência | Líquido incolor |
| Gravidade Específica | 1,62 a 20°C |
| Cor | Incolor |
| Cheiro | Cheiro doce e etéreo |
| Massa molar | 165,83 g/mol |
| Densidade | 1,62 g/mL a 20°C |
| Ponto de fusão | -22,94ºC |
| Ponto de ebulição | 121,1ºC |
| Ponto flash | 55°C |
| Solubilidade em Água | 0,015 g/100 mL a 25°C |
| Solubilidade | Solúvel em álcool e éter |
| Pressão de vapor | 10 mmHg a 20°C |
| Densidade do vapor | 5.7 |
| pKa | 1,8 |
| pH | Não aplicável (substância pura) |
Segurança e perigos do tetracloroetileno
O C2Cl4 pode ser prejudicial se inalado, ingerido ou entrar em contato com a pele ou os olhos. Isso pode causar tontura, dor de cabeça, confusão e irritação respiratória. A exposição a longo prazo pode causar danos ao fígado e aos rins e aumentar o risco de certos tipos de câncer. É importante manusear o C2Cl4 com cuidado e usar equipamento de proteção adequado ao trabalhar com ele. A substância deve ser armazenada em área bem ventilada e afastada de fontes de calor ou ignição. Os derramamentos devem ser imediatamente limpos e descartados adequadamente de acordo com os regulamentos locais.
| Símbolos de perigo | Caveira e Ossos Cruzados, Chama |
| Descrição de segurança | Altamente inflamável, Tóxico por inalação ou ingestão, Pode causar câncer, Pode causar danos a órgãos |
| UM ID | Um 1897 |
| Código SH | 290323 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | III |
| Toxicidade | O tetracloroetileno é classificado como cancerígeno do Grupo 2A (provavelmente cancerígeno para humanos) pela Agência Internacional de Pesquisa sobre o Câncer (IARC) e como toxina reprodutiva de Categoria 2 pela União Europeia. |
Métodos para a síntese de tetracloroetileno
Para sintetizar C2Cl4, podem-se utilizar vários métodos, como a cloração direta do etileno , a cloração do dicloreto de etileno ou a cloração do tetracloreto de carbono.
O gás etileno reage com o gás cloro em um reator para formar C2Cl4 durante o método de cloração direta. Este método pode produzir altos rendimentos de C2Cl4, mas requer um controle cuidadoso das condições de reação para evitar subprodutos indesejados.
O segundo método envolve a cloração do dicloreto de etileno, que é um subproduto da produção de cloreto de vinila. Este método também produz altos rendimentos de C2Cl4, mas pode resultar na formação de subprodutos tóxicos, como o hexaclorobutadieno.
O terceiro método envolve a cloração do tetracloreto de carbono, que pode produzir C2Cl4 como subproduto. No entanto, este método é menos eficiente e produz rendimentos mais baixos do que os outros dois métodos.
Além desses métodos, também é possível produzir C2Cl4 pela reação do tricloroetileno com cloro gasoso ou pela reação do hexacloroetano com fosgênio.
Em escala industrial, os fabricantes geralmente usam a cloração direta de etileno e a cloração com dicloreto de etileno como os métodos mais comumente usados para produzir C2Cl4.
Usos do tetracloroetileno
C2Cl4 tem diversos usos industriais e comerciais, incluindo:
- Lavagem a seco: Amplamente utilizado como solvente para lavagem a seco de roupas devido à sua capacidade de dissolver uma ampla variedade de manchas e sujeiras.
- Desengraxante de metais: Solvente eficaz para remoção de óleo e graxa de superfícies metálicas, tornando-o útil na indústria metalmecânica.
- Adesivos e Selantes: Utilizado como solvente na fabricação de adesivos e selantes, pois pode dissolver diversos tipos de polímeros e resinas.
- Intermediários Químicos: Utilizados como matéria-prima na produção de outros produtos químicos, como solventes clorados e fluorocarbonos.
- Processamento de têxteis e couro: Utilizado no processamento de têxteis e couro como solvente e para remover impurezas.
- Refrigerante: Algumas aplicações utilizam C2Cl4 como refrigerante, mas as preocupações ambientais estão eliminando gradualmente esse uso.
- Solvente de Laboratório: Também usado como solvente de laboratório, principalmente para aplicações de cromatografia e espectroscopia.
Questões:
P: O que é tetracloroetileno?
R: C2Cl4, também conhecido como percloroetileno ou PCE, é um líquido incolor com odor suave que é amplamente utilizado como solvente em diversas aplicações industriais e comerciais.
P: O tetracloroetileno flutuará na água?
R: Não, o C2Cl4 é mais denso que a água, por isso afundará e formará uma camada distinta no fundo.
P: Onde comprar solvente de lavagem a seco tetracloroetileno (percloroetileno)?
R: C2Cl4 é uma substância regulamentada e só pode ser adquirida por profissionais licenciados na indústria de lavagem a seco. Geralmente é adquirido de fornecedores ou distribuidores de produtos químicos especializados em solventes industriais.
P: Qual é a relação entre tetracloroetileno e tetracloreto de carbono?
R: C2Cl4 e tetracloreto de carbono são hidrocarbonetos halogenados que contêm átomos de cloro, mas possuem estruturas e propriedades moleculares diferentes. O tetracloreto de carbono é uma molécula apolar, enquanto o C2Cl4 é polar devido à presença de uma ligação dupla entre dois átomos de carbono.
P: Tetracloroetileno em água?
R: O C2Cl4 é apenas ligeiramente solúvel em água e tende a se dividir no solo e nos sedimentos, tornando-o um contaminante comum das águas subterrâneas e do solo.
P: Empresas de testes de tetracloroetileno?
R: Muitas empresas de testes ambientais oferecem serviços de testes de C2Cl4 para amostras de água, solo e ar. Alguns exemplos incluem ALS Global, Eurofins TestAmerica e Environmental Testing and Consulting, Inc.
P: O que é hibridização de átomos de C em C2Cl4?
R: Os átomos de C em C2Cl4 têm hibridização sp2, o que significa que têm três orbitais híbridos envolvidos na ligação com outros átomos.
P: Qual é o ângulo aproximado da ligação cloro-carbono-cloro em C2Cl4?
R: O ângulo aproximado da ligação cloro-carbono-cloro em C2Cl4 é de 120 graus, o que é característico de moléculas com geometria trigonal planar.
P: O C2Cl4 é polar ou apolar?
R: C2Cl4 é uma molécula polar devido à presença de uma ligação dupla entre os átomos de carbono, o que resulta em uma distribuição de carga assimétrica e um momento de dipolo.
