1-Butanol (C4H9OH) é um álcool incolor com odor levemente adocicado. É utilizado como solvente, em síntese orgânica e como fonte de combustível. Também pode ser utilizado em produtos cosméticos e de higiene pessoal.
| Nome IUPAC | Butan-1-ol |
| Fórmula molecular | C4H10O |
| Número CAS | 71-36-3 |
| Sinônimos | álcool n-butílico, butanol, álcool butílico, álcool 1-butílico, 1-butanol, butanoleno, hidrato de butileno, hidrato de butil |
| InChI | InChI=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Propriedades do 1-butanol
Fórmula 1-Butanol
A fórmula molecular do 1-Butanol é C4H10O. Isso significa que contém quatro átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio. Possui estrutura linear, com o grupo hidroxila (-OH) ligado ao primeiro átomo de carbono.
Massa molar de 1-butanol
A massa molar de C4H9OH é 74,12 g/mol. Isso significa que um mol de C4H9OH pesa 74,12 gramas. A massa molar é uma propriedade importante de uma substância porque ajuda a determinar a quantidade de substância presente em uma determinada amostra.
Ponto de ebulição do 1-butanol
C4H9OH tem um ponto de ebulição de 117,7°C (243,9°F). Isto significa que ele mudará de líquido para gás nesta temperatura. O ponto de ebulição do C4H9OH é superior ao do etanol devido à presença de um átomo de carbono extra.
Ponto de fusão de 1-butanol
O ponto de fusão do C4H9OH é -90,6°C (-131,1°F). Isso significa que ele mudará de sólido para líquido nessa temperatura. O ponto de fusão do C4H9OH é inferior ao do ácido butanóico, que tem peso molecular semelhante.
Densidade de 1-butanol g/ml
A densidade de C4H9OH é 0,81 g/mL. Isto significa que um mililitro de C4H9OH pesa 0,81 gramas. A densidade do C4H9OH é inferior à da água, que tem densidade de 1 g/mL.
Peso Molecular de 1-Butanol
O peso molecular de C4H9OH é 74,12 g/mol. É a soma dos pesos atômicos de todos os átomos de sua fórmula molecular. O peso molecular é uma propriedade importante de uma substância porque ajuda a determinar suas propriedades físicas e químicas.
Estrutura do 1-butanol
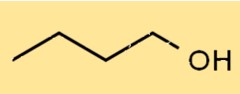
A estrutura do C4H9OH é um álcool de cadeia linear, com o grupo hidroxila (-OH) ligado ao primeiro átomo de carbono. Possui estrutura linear, com quatro átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio. Sua estrutura permite formar ligações de hidrogênio com outras moléculas.
Solubilidade de 1-butanol
C4H9OH é solúvel em água e solventes orgânicos. Sua solubilidade em água diminui com o aumento da temperatura. Também é solúvel em solventes polares, como etanol e metanol. A solubilidade do C4H9OH em solventes orgânicos, como benzeno e éter, é maior do que na água. Isso o torna útil como solvente em síntese orgânica.
| Aparência | Líquido incolor |
| Gravidade Específica | 0,810 g/mL a 25°C |
| Cor | Incolor |
| Cheiro | Ligeiramente doce |
| Massa molar | 74,12 g/mol |
| Densidade | 0,81g/ml |
| Ponto de fusão | -90,6°C (-131,1°F) |
| Ponto de ebulição | 117,7°C (243,9°F) |
| Ponto flash | 35°C (95°F) |
| Solubilidade em Água | 79 g/L a 20°C |
| Solubilidade | Solúvel em etanol, éter dietílico, acetona, benzeno, clorofórmio |
| Pressão de vapor | 1,16kPa a 20°C |
| Densidade do vapor | 2,55 (em relação ao ar) |
| pKa | 16.06 |
| pH | Neutro (7) |
1-Segurança e perigos do butanol
O C4H9OH apresenta vários riscos de segurança, tornando crucial manuseá-lo com cuidado. É um líquido inflamável que pode inflamar facilmente quando exposto ao calor ou faíscas. Também emite vapores nocivos que podem causar irritação e danos aos olhos, aparelho respiratório e pele. Quando ingerido, pode causar sérios problemas de saúde, incluindo tonturas, confusão e até coma. Portanto, é essencial usar equipamentos de proteção como luvas, óculos de proteção e respiradores ao manusear o C4H9OH. Em caso de contato com a pele ou olhos, lavar com água e consultar imediatamente um médico. O armazenamento, manuseio e descarte adequados de C4H9OH são necessários para prevenir acidentes e garantir a segurança.
| Símbolos de perigo | F, Xi |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Use luvas de proteção/proteção ocular/proteção facial. SE ENTRAR EM CONTACTO COM A PELE (ou cabelo): Remova imediatamente todas as roupas contaminadas. Enxaguar a pele com água/tomar banho. SE ENTRAR EM CONTACTO COM OS OLHOS: enxaguar cuidadosamente com água durante vários minutos. Remova as lentes de contato, se presentes e fáceis de retirar. Continue enxaguando. Armazenar em local fresco, seco e bem ventilado, longe de substâncias incompatíveis. |
| Números de identificação da ONU | ONU 1120 |
| Código SH | 2905.16.00 |
| Classe de perigo | 3 |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato) 2,46 g/kg; LC50 (inalação, rato) 37.800 ppm/4h |
Métodos para a síntese de 1-butanol
O C4H9OH pode ser sintetizado por vários métodos, incluindo redução de butiraldeído, processamento oxo ou fermentação.
A fermentação é um método comum para produzir C4H9OH a partir de biomassa. No processo de fermentação, microrganismos como Clostridium acetobutylicum são responsáveis pela produção de uma mistura de ácidos orgânicos e álcoois, incluindo C4H9OH, através da fermentação de açúcares, amidos ou celulose.
O processo oxo, também conhecido como hidroformilação, envolve a reação do propeno com monóxido de carbono e hidrogênio na presença de um catalisador como cobalto ou ródio. A hidrogenação do butiraldeído produz C4H9OH. Quando o butiraldeído sofre hidrogenação, forma o composto C4H9OH.
Outro método de síntese de C4H9OH envolve a redução do butiraldeído com hidrogênio na presença de um catalisador como paládio ou níquel. Esta reação produz C4H9OH com água como subproduto.
O processo Fischer-Tropsch é um método de produção de C4H9OH a partir de combustíveis fósseis. Isso envolve o uso de um catalisador para fazer com que o monóxido de carbono e o hidrogênio reajam, resultando na produção de vários hidrocarbonetos, incluindo C4H9OH.
Usos de 1-butanol
O C4H9OH tem muitos usos em diversas indústrias devido às suas propriedades únicas. Alguns usos comuns de C4H9OH incluem:
- Solvente: Usado como solvente para diversas substâncias, incluindo resinas, gorduras, óleos e ceras.
- Intermediário: Usado como intermediário na produção de outros produtos químicos, como acrilato de butila e acetato de butila.
- Aditivo: Usado como aditivo em gasolina e diesel para aumentar sua octanagem e reduzir emissões.
- Extratante: Utilizado como extratante na produção de antibióticos, vitaminas e hormônios.
- Produtos cosméticos e de higiene pessoal: Utilizados na produção de diversos produtos cosméticos e de higiene pessoal, incluindo loções, cremes e perfumes.
- Sabores e Fragrâncias: Usado como intensificador de sabor e fragrância na indústria de alimentos e bebidas.
- Produtos farmacêuticos: Utilizados na produção de diversos produtos farmacêuticos, incluindo sedativos e hipnóticos.
- Pesticidas: Utilizados como componente na produção de diversos pesticidas e herbicidas.
Questões:
P: O butanol é polar?
R: Sim, o butanol é polar devido à presença do grupo hidroxila (-OH) que lhe confere um momento dipolar.
P: O 1-butanol é solúvel em água?
R: Sim, C4H9OH é parcialmente solúvel em água devido à presença do grupo hidroxila que permite formar ligações de hidrogênio com moléculas de água.
P: O 1-butanol tem uma ligação de hidrogênio?
R: Sim, C4H9OH possui uma ligação de hidrogênio devido à presença do grupo hidroxila (-OH) que pode formar ligações de hidrogênio com outras moléculas de C4H9OH ou com moléculas de água.
P: Quantos ml de 1-butanol são necessários para preparar 725 ml de uma solução aquosa 0,350 μl deste soluto?
R: O cálculo requer a massa molar de C4H9OH, que é 74,12 g/mol. Para preparar uma solução 0,350 M de C4H9OH, são necessários 26,12 g de C4H9OH. Usando a fórmula: moles = concentração x volume, podemos calcular o volume de C4H9OH necessário da seguinte forma: volume = moles/concentração. Assim, o volume de C4H9OH necessário para preparar 725 ml de uma solução de 0,350 μl é (26,12/0,350) = 74,6 ml.
P: Qual álcool se comportará mais como a água? c2h5oh c4h9oh c10h21oh c7h15oh
R: Das opções apresentadas, o etanol (C2H5OH) se comportará mais como a água devido ao seu pequeno tamanho molecular e à presença do grupo hidroxila (-OH), que lhe permite formar fortes ligações de hidrogênio com moléculas de água.
P: Quais são os produtos da equação balanceada para a combustão de c4h9oh?
R: A equação balanceada para a combustão de C4H9OH é: C4H9OH + 6O2 → 4CO2 + 5H2O. Os produtos da reação são dióxido de carbono (CO2) e água (H2O).
P: Qual é a massa molar do butanol (c4h9oh)?
R: A massa molar do butanol (C4H9OH) é 74,12 g/mol.
P: C4h9oh tem uma ligação de hidrogênio?
R: Sim, C4H9OH possui uma ligação de hidrogênio devido à presença do grupo hidroxila (-OH) que permite formar ligações de hidrogênio com outras moléculas de C4H9OH ou com moléculas de água.
P: Quantos gramas de álcool butílico (c4h9oh) existem em uma solução de 2.500 ml, ou 2,22 m?
R: Para calcular o número de gramas de álcool butílico na solução, precisamos usar a fórmula: moles = concentração x volume. A concentração da solução é 2,22 moles/L e o volume é 2,5 L (2500 ml convertidos em L). Portanto, o número de moles de álcool butílico na solução é: 2,22 x 2,5 = 5,55 moles. Para calcular a massa do álcool butílico, multiplique o número de moles pela sua massa molar (74,12 g/mol): 5,55 x 74,12 = 411,4 g. Existem, portanto, 411,4 gramas de álcool butílico em uma solução de 2.500 ml, ou 2,22 M.
