O 2-butanol é um líquido incolor, inflamável e com odor adocicado. É comumente usado como solvente e na produção de produtos químicos como metiletilcetona e acetato de butila.
| Nome IUPAC | 2-Butanol |
| Fórmula molecular | C4H10O |
| Número CAS | 78-92-2 |
| Sinônimos | Álcool butílico seco, álcool 2-butílico, butan-2-ol, etilmetilcarbinol |
| InChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Propriedades do 2-butanol
Fórmula 2-butanol
A fórmula química do 2-Butanol é C4H10O, o que indica que contém quatro átomos de carbono, dez átomos de hidrogênio e um átomo de oxigênio. É um isômero do butanol e possui fórmula estrutural CH3CH(OH)CH2CH3. O “2” no nome do composto significa a posição do grupo hidroxila na cadeia de carbono.
Massa molar de 2-butanol
A massa molar de C4H10O é 74,12 g/mol. Este valor pode ser obtido somando as massas atômicas de todos os átomos do composto, que são 12,01 g/mol para carbono, 1,01 g/mol para hidrogênio e 16,00 g/mol para oxigênio. A massa molar é uma propriedade importante do C4H10O porque é usada para calcular a quantidade de composto necessária nas reações químicas.
Ponto de ebulição do 2-butanol
O ponto de ebulição do C4H10O é 99,5 °C (211,1 °F) à pressão padrão (1 atm). Esta é a temperatura na qual o estado líquido do composto muda para o estado gasoso. O ponto de ebulição do C4H10O é superior ao do butano (-0,5 °C) e do buteno (-6,3 °C) devido à sua ligação de hidrogênio e peso molecular.
Ponto de fusão de 2-butanol
O ponto de fusão do C4H10O é −114,7 °C (−174,5 °F). Esta é a temperatura na qual o estado sólido do composto muda para o estado líquido. O ponto de fusão do C4H10O é inferior ao do butano (-138,4 °C) e do buteno (-185,3 °C) devido à sua estrutura ramificada e ligações de hidrogênio.
Densidade de 2-Butanol g/mL
A densidade do C4H10O é 0,809 g/mL a 25°C (77°F). Este valor indica a massa do composto por unidade de volume da substância. A densidade do C4H10O é superior à do butano (0,588 g/mL) e do buteno (0,587 g/mL) devido ao seu peso molecular e forças intermoleculares.
Peso Molecular de 2-Butanol
O peso molecular de C4H10O é 74,12 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula do composto. O peso molecular é usado para calcular outras propriedades do composto, como massa molar, ponto de ebulição e densidade.
Estrutura do 2-butanol
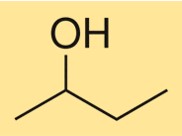
A estrutura do C4H10O é caracterizada por uma cadeia de carbono ramificada com um grupo hidroxila ligado ao segundo átomo de carbono. É um álcool primário com centro quiral, o que significa que existe como dois estereoisômeros, (R)-C4H10O e (S)-C4H10O. O composto possui uma estrutura tridimensional devido ao arranjo tetraédrico dos átomos de carbono e oxigênio ao redor do grupo hidroxila.
Solubilidade de 2-butanol
C4H10O é um composto polar e parcialmente solúvel em água. A solubilidade do C4H10O em água é de 80 g/L a 25°C (77°F). O composto é mais solúvel em solventes orgânicos como etanol, éter e acetona. A solubilidade do C4H10O é influenciada por fatores como temperatura, pressão e natureza do solvente.
| Aparência | Líquido transparente |
| Gravidade Específica | 0,810 g/mL a 25°C (77°F) |
| Cor | Incolor |
| Cheiro | Característica |
| Massa molar | 74,12 g/mol |
| Densidade | 0,809 g/mL a 25°C (77°F) |
| Ponto de fusão | −114,7°C (−174,5°F) |
| Ponto de ebulição | 99,5°C (211,1°F) a 1 atm de pressão |
| Ponto flash | Copo fechado a 39°C (102°F) |
| Solubilidade em Água | 80 g/L a 25°C (77°F) |
| Solubilidade | Solúvel em etanol, éter e acetona |
| Pressão de vapor | 8,7 mmHg a 25°C (77°F) |
| Densidade do vapor | 2,6 (ar = 1) |
| pKa | 16 |
| pH | 7,0-8,5 |
Segurança e perigos do 2-Butanol
O C4H10O é considerado um produto químico relativamente seguro quando manuseado corretamente. No entanto, a exposição a concentrações elevadas pode causar irritação nos olhos, pele e trato respiratório. Também pode causar dores de cabeça, tonturas e náuseas. A ingestão de C4H10O pode causar irritação gastrointestinal e possível depressão do sistema nervoso central. Além disso, o C4H10O é inflamável e pode representar risco de incêndio. Deve ser armazenado em local fresco, seco e bem ventilado, longe de fontes de ignição. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao manusear este produto químico. Os derramamentos devem ser limpos imediatamente usando procedimentos apropriados.
| Símbolos de perigo | F, Xi |
| Descrição de segurança | Manter afastado do calor/faísca/chama aberta/superfícies quentes. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. SE ENTRAR EM CONTACTO COM A PELE (ou cabelo): Remova imediatamente todas as roupas contaminadas. Enxaguar a pele com água/tomar banho. EM CASO DE INALAÇÃO: Remover a vítima para um local ao ar livre e mantê-la em repouso numa posição confortável para respirar. EM CASO DE INGESTÃO: Enxágue a boca. NÃO induza o vômito. Ligue para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou um médico se não se sentir bem. |
| Números de identificação da ONU | ONU1120 |
| Código SH | 2905.13.00 |
| Classe de perigo | 3 – Líquidos inflamáveis |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato): 4,6 g/kg; LC50 (inalação, rato): 2.100 ppm/4 h |
Métodos para a síntese de 2-butanol
Vários métodos podem ser usados para sintetizar C4H10O.
Um método envolve a redução da acetona utilizando borohidreto de sódio na presença de um catalisador de níquel ou paládio. A reação produz uma mistura de C4H10O e seu isômero, isobutanol, que pode ser separado por destilação fracionada.
Outro método envolve a hidratação do 1-buteno utilizando ácido sulfúrico como catalisador. A reação forma uma mistura de C4H10O e seus isômeros, mas o C4H10O desejado pode ser separado por destilação fracionada.
O processo químico Reppe envolve o uso de um catalisador de paládio ou níquel para reagir o acetileno com formaldeído e água, resultando na formação de álcool vinílico. Esta reação leva ainda à síntese de C4H10O. O álcool vinílico então sofre hidrogenação para formar C4H10O.
Outro método de síntese de C4H10O envolve a hidrogenação do crotonaldeído na presença de um catalisador de níquel. A reação produz uma mistura de C4H10O e seu isômero, mas o C4H10O desejado pode ser isolado por destilação fracionada.
Usos do 2-butanol
O C4H10O possui uma variedade de aplicações em diferentes indústrias. Alguns de seus usos são:
- Solvente: Utilizado como solvente na fabricação de resinas, vernizes e revestimentos. Também usado como solvente para éteres e ésteres de celulose.
- Combustível: Utilizado como aditivo de biocombustível devido à sua baixa toxicidade e alto conteúdo energético. Foi demonstrado que tem maior eficiência de combustão que o etanol e está sendo estudado como uma alternativa potencial à gasolina.
- Intermediário químico: utilizado como matéria-prima para a produção de outros produtos químicos, como metiletilcetona, metilisobutilcetona e diisobutileno.
- Perfume e Fragrância: Utilizado como agente de fragrância e aromatizante na produção de perfumes, sabonetes e outros produtos de higiene pessoal.
- Reagente de Laboratório: Utilizado como solvente e reagente em experimentos de química orgânica.
- Agente de Limpeza: Utilizado como agente de limpeza em produtos de limpeza industriais e domésticos.
- Tinta de impressão: Também utilizada como solvente na produção de tintas de impressão.
Questões:
P: Qual composto de carbonila e reagente de Grignard podem ser usados para preparar 2-butanol?
R: O composto carbonílico que pode ser usado para preparar C4H10O é o butanal (também conhecido como n-butiraldeído) e o reagente de Grignard que pode ser usado é o brometo de etil magnésio. A reação entre butanal e brometo de etilmagnésio produz C4H10O como produto final.
P: O 2-butanol é polar?
R: Sim, C4H10O é polar. Ele contém um grupo hidroxila (-OH), que é um grupo funcional polar que torna a molécula polar.
P: O 2-butanol é solúvel em água?
R: Sim, o C4H10O é parcialmente solúvel em água. O grupo hidroxila polar do C4H10O permite formar ligações de hidrogênio com moléculas de água, tornando-o um tanto solúvel em água.
P: O 2-butanol tem uma ligação de hidrogênio?
R: Sim, C4H10O pode formar ligações de hidrogênio. O grupo hidroxila (-OH) em C4H10O pode formar ligações de hidrogênio com outras moléculas polares contendo locais de ligação de hidrogênio, como a água.
