O perclorato de potássio (KClO4) é um composto que contém potássio, cloro e oxigênio. É comumente usado em pirotecnia e explosivos devido às suas propriedades oxidantes.
| Nome da IUPAC | Perclorato de potássio |
| Fórmula molecular | KClO4 |
| Número CAS | 7778-74-7 |
| Sinônimos | Percal K, perclorato de potássio, clorato de potássio (VII), ONU 1489 |
| InChI | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Propriedades do perclorato de potássio
Fórmula de Perclorato de Potássio
O perclorato de potássio tem fórmula química KClO4, o que indica que contém um átomo de potássio, um átomo de cloro e quatro átomos de oxigênio. O composto é um sal inorgânico altamente solúvel em água, o que o torna um oxidante útil em muitas aplicações.
Massa molar de perclorato de potássio
A massa molar do KClO4 é calculada somando as massas atômicas dos elementos constituintes do composto. As massas atômicas de potássio, cloro e oxigênio são 39,10 g/mol, 35,45 g/mol e 16,00 g/mol, respectivamente. Portanto, a massa molar do KClO4 é 138,55 g/mol.
Ponto de ebulição do perclorato de potássio
O KClO4 não tem ponto de ebulição definido, pois se decompõe antes de atingir o ponto de ebulição. Quando aquecido a altas temperaturas, o KClO4 se decompõe em cloreto de potássio e gás oxigênio. Porém, foi observado que o composto pode sublimar em temperaturas em torno de 400 a 500 °C.
Ponto de fusão do perclorato de potássio
O ponto de fusão do KClO4 é aproximadamente 610°C. A esta temperatura, o composto sólido passa para o estado líquido. O alto ponto de fusão do KClO4 o torna adequado para uso em diversas aplicações industriais.
Densidade de perclorato de potássio g/mL
A densidade do KClO4 é de aproximadamente 2,52 g/cm³ à temperatura ambiente. Isso indica que o composto é mais denso que a água, que tem densidade de 1 g/cm³. A alta densidade do KClO4 o torna um oxidante eficaz em pirotecnia.
Peso molecular do perclorato de potássio
O peso molecular do KClO4 é 138,55 g/mol. Este valor é determinado somando as massas atômicas dos elementos constituintes do composto. O peso molecular do KClO4 é útil na determinação da massa do composto necessária para uma reação ou processo específico.
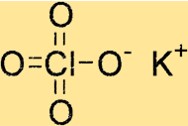
Estrutura do perclorato de potássio
KClO4 tem uma estrutura cristalina tetragonal, o que significa que tem simetria quádrupla em torno de seu eixo c. A estrutura cristalina do composto é formada por íons potássio, íons cloro e íons oxigênio, que são mantidos juntos por ligações iônicas.
Solubilidade do perclorato de potássio
KClO4 é altamente solúvel em água, com solubilidade de aproximadamente 4,5 g/mL à temperatura ambiente. O composto também é solúvel em outros solventes polares, como etanol e acetona. No entanto, é insolúvel em solventes apolares, como benzeno e clorofórmio. A solubilidade do KClO4 é um fator importante na sua utilização como oxidante em diversas aplicações industriais.
| Aparência | Sólido cristalino branco |
| Densidade específica | 2,52 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 138,55 g/mol |
| Densidade | 2,52g/cm³ |
| Ponto de fusão | 610°C |
| Ponto de ebulição | Decompõe-se antes do ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 4,5 g/mL a 25°C |
| Solubilidade | Solúvel em etanol e acetona, insolúvel em benzeno e clorofórmio |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro |
Segurança e perigos do perclorato de potássio
O KClO4 pode representar riscos à segurança se não for manuseado adequadamente. O composto é um oxidante forte e pode reagir com materiais combustíveis causando incêndios ou explosões. A inalação de poeira ou vapor de KClO4 também pode causar irritação do sistema respiratório. A exposição prolongada ao composto pode resultar em irritação da pele ou dermatite. Ao manusear KClO4, é importante utilizar equipamentos de proteção individual adequados, como luvas, óculos de segurança e respiradores. O composto também deve ser armazenado em local fresco e seco, longe de materiais incompatíveis e fontes de calor e ignição.
| Símbolos de perigo | Oxidante |
| Descrição de segurança | Manter afastado de materiais combustíveis. Use equipamento de proteção pessoal apropriado. Evite respirar poeira ou vapores. |
| Números de identificação da ONU | ONU1489 |
| Código SH | 2829.90.90 |
| Classe de perigo | 5.1 – Substâncias oxidantes |
| Grupo de embalagem | II |
| Toxicidade | Pode causar irritação na pele ou dermatite com exposição prolongada. A ingestão ou inalação do composto pode causar irritação respiratória. |
Métodos para a síntese de perclorato de potássio
KClO4 pode ser sintetizado por vários métodos.
Um método comum é reagir o clorato de potássio com o perclorato de bário. A reação produz KClO4 e cloreto de bário como subproduto, que pode ser filtrado.
Outro método envolve a reação do clorato de potássio com ácido clorídrico e cloreto de sódio. A reação produz KClO4 e clorato de sódio, que podem ser separados por cristalização.
A reação entre o hidróxido de potássio e o perclorato de amônio também pode sintetizar KClO4. A reação produz KClO4 e hidróxido de amônio, que podem ser separados por filtração.
Outro método envolve a reação de cloreto de potássio com perclorato de sódio na presença de um catalisador. A reação produz KClO4 e cloreto de sódio, que podem ser separados por cristalização.
Usos do perclorato de potássio
KClO4 tem vários usos em diferentes indústrias. Alguns de seus usos comuns são:
- Pirotecnia: Um agente oxidante popular na indústria pirotécnica. Utilizado na fabricação de fogos de artifício, sinalizadores e outros tipos de explosivos.
- Hélices de foguetes: Utilizadas como oxidante na fabricação de propulsores de foguetes. Comumente usado em propulsores de foguetes sólidos e lançamentos de ônibus espaciais.
- Iniciadores de airbag: Utilizados como iniciador na fabricação de airbags. Para acionar um airbag, uma carga elétrica é enviada através de um fio revestido com KClO4. Isto provoca uma reação que produz gás nitrogênio, que infla o airbag.
- Fósforos: Utilizados na produção de fósforos de segurança. Para produzir um composto combustível que se inflama ao atingir uma superfície áspera, ele é misturado com sulfeto de antimônio e enxofre.
- Galvanoplastia: Utilizado na indústria de galvanoplastia como componente de eletrólitos utilizados para galvanoplastia de metais.
- Medicamento: Usado no tratamento de doenças da tireoide, como hipertireoidismo. No entanto, o seu uso na medicina diminuiu devido a questões de segurança.
- Química analítica: Também utilizada como reagente em química analítica para a determinação de certas substâncias.
Questões:
P: Que tipos de ligações estão contidas em uma molécula de perclorato de potássio?
R: KClO4 contém ligações iônicas e covalentes. O íon K+ e o íon ClO4- são mantidos juntos por ligações iônicas, enquanto o próprio íon perclorato contém ligações covalentes e iônicas.
P: Qual é a fórmula do perclorato de potássio?
R: KClO4.
P: O perclorato de potássio é aquoso?
R: O KClO4 pode se dissolver na água, tornando-a aquosa sob certas condições.
P: Para que é usado o perclorato de potássio?
R: O KClO4 tem diversas aplicações, inclusive em fogos de artifício, propulsores de foguetes e infladores de airbag. Também é usado em química analítica como reagente e agente oxidante.
P: Como fazer flash em pó sem perclorato de potássio?
R: O pó flash pode ser produzido sem KClO4 usando oxidantes alternativos, como perclorato de amônio, perclorato de sódio ou peróxido de bário.
P: Qual é o estado de oxidação de um átomo de cloro individual no KClO4?
R: O estado de oxidação do átomo de cloro individual em KClO4 é +7.
P: O KClO4 é solúvel em água?
R: Sim, KClO4 é solúvel em água.
P: O KClO4 é um ácido ou uma base?
R: KClO4 não é um ácido nem uma base. É um sal composto por um metal (potássio) e um íon poliatômico (perclorato).
