O clorato de magnésio (Mg(ClO3)2) é um composto composto por íons Mg2+ e ClO3-. É um pó cristalino branco solúvel em água e altamente reativo. Pode ser utilizado como agente oxidante na produção de fogos de artifício e como desinfetante no tratamento de água.
| Nome IUPAC | Clorato de magnésio |
| Fórmula molecular | Mg(ClO3)2 |
| Número CAS | 10326-21-3 |
| Sinônimos | Diperclorato de magnésio, clorato de magnésio (II), clorato de magnésio hexahidratado |
| InChI | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Propriedades do clorato de magnésio
Fórmula de Clorato de Magnésio
O clorato de magnésio é um composto químico com a fórmula Mg(ClO3)2. O composto é composto por um íon magnésio (Mg2+) e dois íons ClO3. A fórmula química afirma que uma molécula de clorato de magnésio contém dois íons cloreto e seis átomos de oxigênio.
Massa molar de clorato de magnésio
A massa molar do Mg(ClO3)2 é 191,2 g/mol. Este valor é calculado somando os pesos atômicos dos elementos presentes em uma molécula de Mg(ClO3)2. O magnésio tem massa molar de 24,31 g/mol, enquanto o cloro e o oxigênio têm massas molares de 35,45 g/mol e 16,00 g/mol, respectivamente. Multiplicando a massa molar de cada elemento pelo número de átomos desse elemento na molécula e somando-os, obtemos a massa molar do composto.
Ponto de ebulição do clorato de magnésio
O Mg(ClO3)2 se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, o Mg(ClO3)2 se decompõe em cloreto de magnésio, gás oxigênio e gás cloro. Portanto, Mg(ClO3)2 não tem ponto de ebulição.
Clorato de magnésio Ponto de fusão
O ponto de fusão do Mg(ClO3)2 é 105°C. A esta temperatura, o composto sólido se transforma em líquido. O ponto de fusão do Mg(ClO3)2 pode variar dependendo da pureza do composto e das condições sob as quais é medido.
Densidade de clorato de magnésio g/mL
A densidade do Mg(ClO3)2 é 2,21 g/mL. Isso significa que um mililitro de Mg(ClO3)2 tem massa de 2,21 gramas. A densidade de Mg(ClO3)2 pode ser usada para calcular o volume de uma determinada massa do composto ou a massa de um determinado volume do composto.
Peso molecular do clorato de magnésio
O peso molecular do Mg(ClO3)2 é 191,2 g/mol. Este valor é calculado somando os pesos atômicos dos elementos presentes em uma molécula de Mg(ClO3)2.
Estrutura do clorato de magnésio
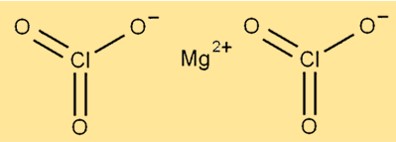
A estrutura do Mg(ClO3)2 é composta por íons de magnésio rodeados por seis átomos de oxigênio e dois átomos de cloro. O íon magnésio está localizado no centro da molécula, enquanto os átomos de oxigênio e cloro estão dispostos ao seu redor. O composto possui estrutura cristalina e cor branca.
Solubilidade do clorato de magnésio
Mg(ClO3)2 é solúvel em água, etanol e acetona. A solubilidade do Mg(ClO3)2 em água aumenta com a temperatura. À temperatura ambiente, aproximadamente 31 gramas de Mg(ClO3)2 podem dissolver-se em 100 ml de água. A solubilidade do Mg(ClO3)2 em outros solventes depende da polaridade do solvente.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,21g/cm3 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 191,2 g/mol |
| Densidade | 2,21g/ml |
| Ponto de fusão | 105ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, etanol e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do clorato de magnésio
O Mg(ClO3)2 é um forte agente oxidante e pode reagir violentamente com materiais combustíveis, causando incêndios ou explosões. Também pode causar irritação na pele, olhos e sistema respiratório por contato ou inalação. Portanto, equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao manusear Mg(ClO3)2. O composto também deve ser armazenado longe de materiais combustíveis e fontes de calor ou ignição. Além disso, deve ser fornecida ventilação adequada para evitar a inalação de poeira ou vapor do composto. O Mg(ClO3)2 deve ser manuseado com cuidado para evitar perigos potenciais.
| Símbolos de perigo | Oxidante |
| Descrição de segurança | Evite o contato com materiais combustíveis, use luvas e óculos de proteção, garanta ventilação adequada |
| Números de identificação da ONU | ONU1475 |
| Código SH | 2829.90.90 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Pode causar irritação na pele, olhos e vias respiratórias; Pode ser perigoso se engolido |
Métodos de síntese de clorato de magnésio
Diferentes métodos podem ser usados para sintetizar Mg(ClO3)2.
Um método comum é reagir o hidróxido de magnésio com ácido clórico. A reação prossegue da seguinte forma:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Outro método é reagir o carbonato de magnésio com ácido perclórico. A reação prossegue da seguinte forma:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Um terceiro método envolve a eletrólise do cloreto de magnésio na presença de um sal clorato, tal como clorato de sódio ou potássio. A reação prossegue da seguinte forma:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Neste método, o processo de eletrólise utiliza um ânodo de magnésio e utiliza sal clorato como agente oxidante.
Usos do clorato de magnésio
Mg(ClO3)2 tem vários usos em diferentes campos. Aqui estão algumas de suas aplicações:
- Produtos Pirotécnicos: Comumente usados como oxidante em composições pirotécnicas, como sinalizadores, fogos de artifício e dispositivos de sinalização.
- Síntese química: Usado como fonte de oxigênio na síntese de vários produtos químicos, incluindo produtos farmacêuticos, corantes e explosivos.
- Alvejante: Utilizado como agente branqueador na produção de papel, celulose e têxteis.
- Tratamento de Água: Também utilizado como agente de tratamento de água para remover impurezas e bactérias presentes na água.
- Reagente de Laboratório: Usado como reagente de laboratório em vários métodos de química analítica.
- Agricultura: Usado como fertilizante e condicionador de solo para fornecer magnésio e oxigênio às plantas.
- Indústria de Petróleo e Gás: Usado como oxidante em operações de perfuração e detonação na indústria de petróleo e gás.
Questões:
P: Qual é a fórmula do clorato de magnésio?
R: Mg(ClO3)2.
P: Quantos átomos existem em 2,1 moles de Mg(ClO3)2?
R: Existem 5,04 x 10^24 átomos em 2,1 moles de Mg(ClO3)2.
P: O clorato de magnésio se decompõe em quê?
R: Mg(ClO3)2 pode se transformar em cloreto de magnésio, gás oxigênio e gás cloro quando aquecido.
P: Como o clorato de magnésio se decompõe?
R: Mg(ClO3)2 se decompõe em cloreto de magnésio e gás oxigênio quando aquecido.
P: Qual é o número total de átomos de oxigênio presentes em uma unidade de Mg(ClO3)2?
R: Existem 6 átomos de oxigênio presentes em uma unidade de Mg(ClO3)2.
P: Em que se decompõe o Mg(ClO3)2?
R: Mg(ClO3)2 se decompõe para formar MgCl2 e O2 quando aquecido.
P: Qual é o número total de moles de átomos de oxigênio presentes em um mol de Mg(ClO3)2?
R: Existem 6 moles de átomos de oxigênio presentes em um mol de Mg(ClO3)2.
P: Qual é a massa em gramas de Mg(ClO3)2?
R: A massa da fórmula em gramas de Mg(ClO3)2 é 232,21 g/mol.
P: O Mg(ClO3)2 é iônico ou molecular?
R: Mg(ClO3)2 é um composto iônico.
