O metabissulfito de sódio (Na2S2O5) é um composto químico utilizado como conservante e antioxidante em alimentos e bebidas. Também pode ser usado como desinfetante e agente branqueador em diversas indústrias.
| Nome IUPAC | Pirossulfito de sódio |
| Fórmula molecular | Na2S2O5 |
| Número CAS | 7681-57-4 |
| Sinônimos | Dissulfito dissódico, ácido pirossulfuroso, sal dissódico, pirossulfito de sódio, dissulfito de sódio |
| InChI | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Propriedades do metabissulfito de sódio
Fórmula de Metabissulfito de Sódio
A fórmula química do metabissulfito de sódio é Na2S2O5. É composto por dois íons sódio (Na+) e um íon dissulfito (S2O5-2). O composto é um pó cristalino branco ou amarelado, solúvel em água e que emite odor pungente.
Massa molar de Metabissulfito de Sódio
A massa molar de Na2S2O5 é 190,107 g/mol. Esse valor é calculado somando as massas atômicas dos elementos do composto, que são 22,99 g/mol para o sódio, 32,06 g/mol para o enxofre e 15,99 g/mol para o oxigênio. A massa molar é uma propriedade importante que ajuda a determinar quanto de uma substância é necessária para uma reação química.
Ponto de ebulição do metabissulfito de sódio
O Na2S2O5 tem um alto ponto de fusão de 150°C, mas se decompõe antes de ferver. O composto se decompõe em dióxido de enxofre (SO2) e sulfito de sódio (Na2SO3) a uma temperatura de aproximadamente 150°C. Portanto, o ponto de ebulição do Na2S2O5 não é aplicável.
Ponto de fusão do metabissulfito de sódio
O ponto de fusão do Na2S2O5 é 150°C. A esta temperatura, o composto sofre uma mudança de fase de sólido para líquido. O ponto de fusão é uma propriedade física importante que ajuda a identificar e caracterizar uma substância.
Densidade de metabissulfito de sódio g/mL
A densidade do Na2S2O5 é 1,48 g/mL. É um composto relativamente denso que afunda na água. A densidade de uma substância é a massa por unidade de volume e é uma propriedade física importante que ajuda a determinar quanto de uma substância existe em um determinado volume.
Peso molecular do metabissulfito de sódio
O peso molecular do Na2S2O5 é 190,107 g/mol. É a soma dos pesos atômicos de todos os átomos do composto. O peso molecular é uma propriedade importante que ajuda a calcular a quantidade de uma substância necessária para uma reação química.
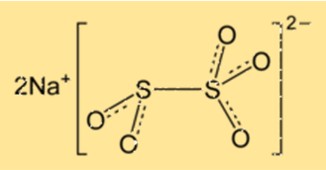
Estrutura do metabissulfito de sódio
O Na2S2O5 possui estrutura cristalina e pertence ao sistema cristalino ortorrômbico. A rede cristalina é composta de íons sódio e íons dissulfito dispostos em um padrão repetitivo. O composto possui geometria molecular tetraédrica, com os átomos de enxofre no centro do tetraedro.
Solubilidade do metabissulfito de sódio
O Na2S2O5 é altamente solúvel em água, com solubilidade de 54 g/100 mL a 25°C. Também é solúvel em glicerol e ligeiramente solúvel em etanol. A solubilidade de uma substância é uma propriedade importante que determina sua capacidade de dissolução em um determinado solvente.
| Aparência | Pó cristalino branco ou amarelado |
| Gravidade Específica | 1,48 |
| Cor | Branco a amarelado |
| Cheiro | Acre |
| Massa molar | 190,107 g/mol |
| Densidade | 1,48g/ml |
| Ponto de fusão | 150ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 54 g/100 mL a 25°C |
| Solubilidade | Solúvel em glicerol e ligeiramente solúvel em etanol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | 7.2 |
| pH | 4,5 (solução a 5%) |
Segurança e perigos do metabissulfito de sódio
O Na2S2O5 pode ser perigoso se não for manuseado adequadamente. É um forte agente redutor que pode causar irritação na pele, olhos e sistema respiratório após exposição. A ingestão do composto pode causar sérios problemas gastrointestinais. O Na2S2O5 deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis. Não deve ser misturado com ácidos fortes, oxidantes fortes ou agentes redutores. Equipamentos de proteção, como luvas, óculos de proteção e respiradores, devem ser usados ao manusear o composto. Medidas de emergência, como lava-olhos e extintores de incêndio, devem estar prontamente disponíveis em caso de acidente.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Use roupas e luvas de proteção. Não ingira. Use com ventilação adequada. |
| Números de identificação da ONU | ONU 2676 |
| Código SH | 2832.10.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato): 1.000 mg/kg; LC50 (inalação, rato): 11 mg/L (4 horas) |
Métodos para a síntese de metabissulfito de sódio
O Na2S2O5 pode ser sintetizado por vários métodos, incluindo a reação do bissulfito de sódio com dióxido de enxofre na presença de um agente oxidante como o peróxido de hidrogênio . O processo aquece o aduto de bissulfito de sódio e dióxido de enxofre para formar Na2S2O5.
Outro método envolve a reação do hidróxido de sódio com gás dióxido de enxofre, seguida pela adição de ácido sulfúrico para formar sulfato de sódio e Na2S2O5.
Outro método de síntese envolve a reação do carbonato de sódio com dióxido de enxofre e depois o aquecimento do sulfito de sódio resultante na presença de ar. Este processo produz sulfato de sódio e Na2S2O5.
Na presença de um agente oxidante como peróxido de hidrogênio ou ácido nítrico, o Na2S2O5 pode ser preparado pela reação do enxofre com sulfito de sódio.
Na indústria, o método mais comum de síntese de Na2S2O5 é reagir o bissulfito de sódio com dióxido de enxofre na presença de um catalisador como o dióxido de manganês. O aquecimento do aduto de bissulfito de sódio/dióxido de enxofre forma Na2S2O5.
Usos do metabissulfito de sódio
O Na2S2O5 tem diversas utilizações em diversas indústrias devido às suas fortes propriedades redutoras e à sua capacidade de atuar como conservante e antioxidante. Alguns dos usos comuns de Na2S2O5 incluem:
- Indústria de alimentos e bebidas: amplamente utilizado como conservante e antioxidante em produtos alimentícios e bebidas, como vinho, cerveja, sucos de frutas e frutas secas. Isto ajuda a prevenir a deterioração e oxidação destes produtos, prolongando assim a sua vida útil.
- Indústria Farmacêutica: Utilizado como antioxidante em diversos produtos farmacêuticos como cremes, pomadas e comprimidos. Ajuda a prevenir a degradação destes produtos devido à exposição ao ar e à luz.
- Tratamento de Água: Usado para desclorar água em estações de tratamento de água. Ajuda a eliminar o excesso de cloro e cloraminas, que podem ser prejudiciais à vida aquática.
- Fotografia: Usado como revelador e fixador fotográfico na indústria fotográfica. Ajuda a reduzir os íons de prata a prata metálica, formando assim a imagem fotográfica.
- Indústria têxtil: Utilizado como agente redutor na indústria têxtil para processos de tingimento e estamparia. Ajuda a remover o excesso de oxigênio da solução corante, melhorando a intensidade e uniformidade da cor.
Questões:
P: Onde posso comprar metabissulfito de sódio localmente?
R: O Na2S2O5 geralmente pode ser encontrado em lojas de produtos químicos ou varejistas online. Também pode estar disponível em algumas lojas especializadas em alimentos, pois é comumente usado como conservante na indústria alimentícia.
P: Onde comprar metabissulfito de sódio?
R: O Na2S2O5 pode ser adquirido em lojas de produtos químicos ou varejistas on-line de produtos químicos especializados. Também pode estar disponível em algumas lojas especializadas em alimentos.
P: O metabissulfito de sódio é seguro?
R: O Na2S2O5 pode ser perigoso se não for manuseado corretamente. É importante usar equipamento de proteção adequado e seguir as precauções de segurança ao manusear este composto. Pode causar irritação na pele e nos olhos e também liberar dióxido de enxofre tóxico se misturado com ácido. No entanto, quando utilizado em concentrações apropriadas e manuseado com cuidado, o Na2S2O5 é geralmente considerado seguro para os usos pretendidos.
P: Você pode transformar o bissulfato de sódio em metabissulfito de sódio?
R: Sim, o bissulfato de sódio (NaHSO4) pode ser convertido em Na2S2O5 aquecendo-o a alta temperatura na presença de um agente oxidante, como o peróxido de hidrogênio. A reação resulta na liberação de água e na formação de Na2S2O5.
P: Qual é a diferença entre bissulfito de sódio e metabissulfito de sódio?
R: A principal diferença entre NaHSO3 e Na2S2O5 é a sua estrutura química. O bissulfito de sódio possui um grupo sulfito (-SO3) e um íon hidrogênio (H+), enquanto o Na2S2O5 possui dois grupos sulfito (-SO3) ligados entre si. O Na2S2O5 também é mais estável e tem uma vida útil mais longa que o bissulfito de sódio.
P: Qual é o número de oxidação do S em Na2S2O5?
R: O número de oxidação do enxofre (S) em Na2S2O5 é +5.
P: Como encontrar a concentração de IO3- de KIO3 e Na2S2O5?
R: A concentração de IO3- pode ser determinada por titulação com concentração conhecida de tiossulfato de sódio (Na2S2O3), utilizando amido como indicador. A reação entre KIO3 e Na2S2O5 produz iodo (I2), que reage com Na2S2O3 para formar NaI e Na2S4O6. Medindo o volume de Na2S2O3 necessário para reagir com o iodo, a concentração de IO3- pode ser calculada.
P: Quais íons o Na2S2O5 contém?
R: Na2S2O5 é composto por dois íons sódio (Na+) e um íon dissulfito (-S2O5).
