O hidrossulfito de sódio (Na2S2O4) é um pó cristalino branco utilizado como agente redutor em diversas indústrias, como têxtil e papel. Remove a cor de tecidos e polpa de papel.
| Nome IUPAC | Dionito de sódio |
| Fórmula molecular | Na2S2O4 |
| Número CAS | 7775-14-6 |
| Sinônimos | Hipossulfito de sódio, ditionato de sódio, sulfoxilato de sódio, hidrogenossulfito de sódio |
| InChI | InChI=1S/2Na.H2O4S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriedades do hidrossulfito de sódio
Fórmula de Hidrossulfito de Sódio
A fórmula química do hidrossulfito de sódio é Na2S2O4. Isto significa que cada molécula de hidrossulfito de sódio contém dois átomos de sódio, dois átomos de enxofre e quatro átomos de oxigênio. A fórmula indica que o composto consiste em íons de sódio com carga positiva e íons sulfito com carga negativa.
Massa molar de hidrossulfito de sódio
A massa molar de Na2S2O4 é 174,11 g/mol. Este valor é calculado somando as massas atômicas dos elementos presentes em uma molécula de Na2S2O4. A massa molar é um parâmetro importante na estequiometria e é usada para calcular a quantidade de substância em uma determinada amostra do composto.
Ponto de ebulição do hidrossulfito de sódio
Na2S2O4 é um composto estável e não possui ponto de ebulição. Em vez disso, decompõe-se quando aquecido acima de 150°C para libertar dióxido de enxofre e vapor de água. A reação de decomposição é exotérmica e deve-se ter cuidado ao aquecer o Na2S2O4.
Ponto de fusão do hidrossulfito de sódio
O ponto de fusão do Na2S2O4 é 300°C. A esta temperatura, o composto sólido derrete para formar um líquido incolor. O ponto de fusão é um parâmetro importante na determinação da estabilidade do composto e sua adequação para diferentes aplicações.
Densidade de hidrossulfito de sódio g/ml
A densidade do Na2S2O4 é 1,48 g/ml. Este valor indica que o Na2S2O4 é um composto relativamente denso comparado à água. A densidade é um parâmetro importante na determinação da solubilidade do composto e da sua capacidade de se misturar com outras substâncias.
Peso Molecular de Hidrossulfito de Sódio
O peso molecular do Na2S2O4 é 174,11 g/mol. Este valor é calculado somando as massas atômicas dos elementos presentes em uma molécula de Na2S2O4. O peso molecular é um parâmetro importante na determinação da quantidade de substância em uma determinada amostra do composto.
Estrutura do hidrossulfito de sódio
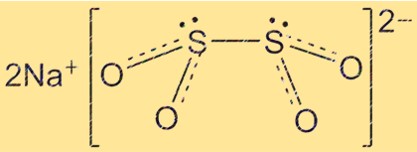
A estrutura do Na2S2O4 é tetraédrica, com os átomos de enxofre localizados nos cantos do tetraedro e os átomos de oxigênio formando as bordas. Os íons de sódio estão localizados no centro do tetraedro. A estrutura do Na2S2O4 é importante para a compreensão de suas propriedades químicas e físicas.
Solubilidade do hidrossulfito de sódio
O Na2S2O4 é altamente solúvel em água, com solubilidade de 58 g/100 mL a 20°C. A solubilidade é afetada pela temperatura e pelo pH, com maior solubilidade observada em temperaturas mais altas e valores de pH mais baixos. A alta solubilidade do Na2S2O4 o torna útil em diversas aplicações, como nas indústrias têxtil e de papel, onde é utilizado como agente redutor.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 1,48 |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 174,11 g/mol |
| Densidade | 1,48g/ml |
| Ponto de fusão | 300ºC |
| Ponto de ebulição | Decompõe-se a 150°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água, glicerol, etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 6.6 |
| pH | 7-8 (solução a 1%) |
Segurança e perigos do hidrossulfito de sódio
O Na2S2O4 é geralmente seguro quando manuseado e usado corretamente, mas pode representar alguns perigos se manuseado incorretamente ou usado de forma inadequada. É classificado como substância perigosa e pode causar irritação na pele e nos olhos se entrar em contato com essas partes do corpo. A inalação de poeira ou névoa de Na2S2O4 também pode irritar o sistema respiratório. O Na2S2O4 também é um agente redutor, o que significa que pode reagir com outros produtos químicos para produzir gases inflamáveis ou explosivos. Devem ser seguidas medidas de segurança adequadas, como o uso de equipamento de proteção e o manuseamento da substância em áreas bem ventiladas, para evitar acidentes e lesões.
| Símbolos de perigo | XI, C |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Não inale poeira ou névoa. Use equipamento de proteção. Manuseie em áreas bem ventiladas. |
| Números de identificação da ONU | ONU1384 |
| Código SH | 28311000 |
| Classe de perigo | 4.2 |
| Grupo de embalagem | III |
| Toxicidade | LD50: 1.520 mg/kg (oral, rato); LC50: 1840 ppm/4h (inalação, rato) |
Métodos para a síntese de hidrossulfito de sódio
Existem vários métodos para sintetizar Na2S2O4, mas os mais comuns envolvem a reação de bissulfito de sódio e ditionito de sódio.
Um método envolve a adição de bissulfito de sódio a uma solução de hidróxido de sódio e ditionito de sódio, enquanto outro método envolve o aquecimento de uma mistura de bissulfito de sódio e ditionito de sódio.
A formação de Na2S2O4 produz um pó cristalino branco que pode ser coletado e purificado por ambos os métodos.
Outro método de síntese de Na2S2O4 envolve a reação entre dióxido de enxofre e borohidreto de sódio . A reação produz Na2S2O4, bem como borato de sódio e gás hidrogênio. Este método é geralmente menos comum que os métodos do bissulfito de sódio e do ditionito de sódio.
Usos do hidrossulfito de sódio
O Na2S2O4 tem diversos usos em diferentes indústrias devido às suas propriedades únicas. Aqui estão alguns de seus usos:
- Indústria Têxtil: Utilizado como agente redutor na indústria têxtil para remover o excesso de tingimento e branqueamento dos tecidos.
- Indústria de Papel: Utilizado na indústria de papel para branquear celulose e produtos de papel.
- Indústria Alimentar: Utilizado como aditivo alimentar para prevenir a descoloração e como conservante em frutas e vegetais enlatados.
- Tratamento de Água: Utilizado para remover o excesso de cloro no tratamento de água potável e esgoto.
- Indústria de mineração: Usado na indústria de mineração para separar minérios de cobre e molibdênio.
- Indústria de Polímeros: Usado na indústria de polímeros para reduzir a cor de polímeros e plásticos.
- Indústria fotográfica: Usado na indústria fotográfica como fixador fotográfico para remover haletos de prata não expostos de impressões fotográficas.
- Outras aplicações industriais: Utilizado em diversas outras indústrias, como processamento de couro, perfuração de petróleo e como agente redutor em reações de síntese química.
Questões:
P: Qual limpador contém hidrossulfito de sódio?
R: O Na2S2O4 é comumente usado em produtos de limpeza domésticos para remover manchas e como alternativa ao alvejante.
P: Qual é a função do hidrossulfito de sódio na reação com o índigo?
R: O Na2S2O4 atua como agente redutor na reação com o índigo, que converte o corante azul índigo insolúvel em um composto solúvel e incolor.
P: Onde comprar hidrossulfito de sódio?
R: O Na2S2O4 pode ser adquirido de fornecedores de produtos químicos, como Sigma-Aldrich, Fisher Scientific e VWR International.
P: Como neutralizar o hidrossulfito de sódio?
R: O Na2S2O4 pode ser neutralizado com hidróxido de sódio ou outra base forte.
P: Quais alimentos indianos usam hidrossulfito de sódio?
R: O Na2S2O4 não é comumente usado em alimentos indianos.
P: Como o hidrossulfito de sódio embranquece?
R: O Na2S2O4 atua como agente redutor e destrói as ligações químicas que dão cor ao material, eliminando a cor e levando ao branqueamento.
P: Qual é a função do hidrossulfito de sódio na reação com o índigo?
R: O Na2S2O4 atua como agente redutor na reação com o índigo, que converte o corante azul índigo insolúvel em um composto solúvel e incolor.
P: O que produz odor ao adicionar hidrossulfito de sódio?
R: Ao adicionar Na2S2O4, pode produzir um cheiro de enxofre devido à liberação de gás dióxido de enxofre.
P: O hidrossulfito de sódio di-hidratado é um agente redutor?
R: Sim, o Na2S2O4 di-hidratado é um poderoso agente redutor comumente usado em processos industriais.
