O sulfito de potássio (K2SO3) é um composto químico composto de potássio, enxofre e oxigênio. É comumente usado como conservante na indústria alimentícia para evitar descoloração e deterioração.
| Nome IUPAC | Sulfito de potássio |
| Fórmula molecular | K2SO3 |
| Número CAS | 10117-38-1 |
| Sinônimos | Sulfito dipotássico; Sal dipotássico de ácido sulfuroso; Sulfonato de potássio; Óxido de enxofre e potássio |
| InChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Sulfito de Potássio
Fórmula de Sulfito de Potássio
O sulfito de potássio tem a fórmula química K2SO3, o que indica que contém dois átomos de potássio, um átomo de enxofre e três átomos de oxigênio. O composto é formado pela reação entre o hidróxido de potássio (KOH) e o dióxido de enxofre (SO2). O sulfito de potássio é um composto iônico, o que significa que é composto de íons de potássio carregados positivamente e íons sulfito carregados negativamente. A fórmula do íon sulfito é SO32-.
Massa molar de Sulfito de Potássio
A massa molar do K2SO3 é 158,26 g/mol. Isso é calculado adicionando as massas atômicas de cada elemento na fórmula (2 x massa atômica de K) + massa atômica de S + (3 x massa atômica de O). A massa molar de um composto é importante porque ajuda a calcular a quantidade de composto necessária para uma determinada reação ou a determinar a concentração de uma solução.
Ponto de ebulição do sulfito de potássio
O K2SO3 não possui ponto de ebulição específico porque se decompõe antes de atingir seu ponto de ebulição. Porém, quando aquecido, o K2SO3 sofre decomposição térmica para formar sulfato de potássio (K2SO4) e dióxido de enxofre (SO2). A temperatura de decomposição é de aproximadamente 390°C.
Ponto de fusão de sulfito de potássio
O ponto de fusão do K2SO3 é de cerca de 350°C. A esta temperatura, o composto sólido se transforma em líquido. Porém, à medida que a temperatura aumenta, o K2SO3 se decompõe, conforme mencionado anteriormente.
Densidade de sulfito de potássio g/mL
A densidade do K2SO3 é 2,44 g/mL à temperatura ambiente. A densidade é definida como a massa de uma substância por unidade de volume. A alta densidade do K2SO3 indica que é um composto relativamente pesado. Esta propriedade é importante na determinação das propriedades físicas do composto, tais como sua solubilidade e reatividade.
Peso Molecular de Sulfito de Potássio
O peso molecular do K2SO3 é 158,26 g/mol. Este valor representa a massa média de uma molécula do composto. O peso molecular é importante para calcular a quantidade de uma substância em um determinado volume ou massa, o que é útil em reações químicas e experimentos de laboratório.
Estrutura do sulfito de potássio
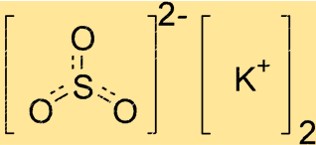
K2SO3 tem uma estrutura cristalina, o que significa que seus átomos estão dispostos em um padrão repetitivo. O composto possui geometria trigonal planar, com o átomo de enxofre no centro e os três átomos de oxigênio dispostos simetricamente ao seu redor. Os íons potássio estão localizados fora desta estrutura, equilibrando a carga negativa dos íons sulfito.
Solubilidade do sulfito de potássio
K2SO3 é altamente solúvel em água. À temperatura ambiente, pode dissolver-se em água para formar uma solução límpida e incolor. A solubilidade do K2SO3 se deve à sua natureza iônica, que permite que ele se dissocie em seus íons constituintes na água. A solubilidade do K2SO3 também é afetada pela temperatura, com a solubilidade aumentando à medida que a temperatura aumenta.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,44 |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 158,26 g/mol |
| Densidade | 2,44g/ml |
| Ponto de fusão | 350ºC |
| Ponto de ebulição | Decompõe-se a 390°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em etanol e glicerol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 10,3 (para ácido sulfuroso) |
| pH | ~9 (para uma solução de 0,1 M) |
Segurança e perigos do sulfito de potássio
O K2SO3 é relativamente seguro de manusear e usar se forem tomadas as devidas precauções. No entanto, pode representar perigos se não for manuseado com cuidado. O composto pode causar irritação na pele, olhos e aparelho respiratório se entrar em contato com essas partes do corpo. K2SO3 também pode causar problemas gastrointestinais se ingerido. Além disso, o composto representa um risco potencial de incêndio e explosão quando exposto ao calor ou chama. Portanto, medidas de segurança adequadas devem ser tomadas ao trabalhar com K2SO3, como usar equipamento de proteção e armazenar o composto longe de calor e de fontes de ignição.
| Símbolos de perigo | Caveira e ossos cruzados |
| Descrição de segurança | Tóxico, prejudicial se ingerido, irritante para a pele e os olhos |
| Números de identificação da ONU | ONU 2697 |
| Código SH | 283210 |
| Classe de perigo | 6.1 (Substâncias tóxicas) |
| Grupo de embalagem | II (Perigo médio) |
| Toxicidade | Oral (LD50): 345 mg/kg (rato) |
Métodos de síntese de sulfito de potássio
O K2SO3 pode ser sintetizado por diferentes métodos, incluindo a reação do hidróxido de potássio com dióxido de enxofre ou enxofre, a reação do carbonato de potássio com dióxido de enxofre e a reação do bissulfito de potássio com hidróxido. potássio.
No primeiro método, uma solução de hidróxido de potássio reage com o gás dióxido de enxofre na presença de água para formar K2SO3. No segundo método, uma mistura de carbonato de potássio e dióxido de enxofre é aquecida a altas temperaturas para produzir K2SO3. O terceiro método envolve a mistura de bissulfito de potássio com hidróxido de potássio para produzir K2SO3 e água.
Outro método comum de síntese de K2SO3 é a reação do dióxido de enxofre com um sal de potássio, como o cloreto de potássio, na presença de agentes redutores como hidrossulfito de sódio ou sulfato de ferro (II). Este método é frequentemente usado em ambientes industriais para produzir grandes quantidades de K2SO3.
Usos do Sulfito de Potássio
O K2SO3 possui diversas aplicações em diferentes indústrias devido às suas propriedades químicas. Aqui estão alguns usos comuns do K2SO3:
- Indústria de alimentos e bebidas: utilizado como conservante de alimentos para evitar a deterioração e descoloração de alimentos como vinho, frutas secas e camarão.
- Fotografia: Usado como agente de fixação fotográfica para evitar o desenvolvimento do filme e tornar a imagem permanente.
- Tratamento de Água: Usado como agente redutor para remover o cloro da água e para tratar águas residuais.
- Indústria de papel: Utilizado como agente branqueador para remover impurezas e branquear a polpa no processo de fabricação de papel.
- Indústria têxtil: Utilizado como agente redutor para remover o excesso de corante dos tecidos e para branquear têxteis.
- Indústria química: utilizado como agente redutor em reações químicas para converter agentes oxidantes em agentes redutores.
- Indústria Medicinal: Utilizado em alguns tratamentos médicos para prevenir ou aliviar sintomas de certas condições.
Questões:
P: Qual é a fórmula do sulfito de potássio?
R: A fórmula do sulfito de potássio é K2SO3.
P: O sulfato de potássio é um sulfito?
R: Não, o sulfato de potássio não é um sulfito. É um sal composto por potássio, enxofre e oxigênio com fórmula química K2SO4.
P: Que sal é produzido quando o H2SO4 reage com o NaOH? K2SO3, Na2SO4, Na2SO3, K2SO4
R: Quando o H2SO4 reage com o NaOH, o sal produzido é o Na2SO4.
P: Quantos íons SO32 estão contidos em 99,6 mg de Na2SO3?
A massa molar do Na2SO3 é 126,05 g/mol. R: Para calcular o número de íons SO32-, primeiro precisamos encontrar o número de moles de Na2SO3: 99,6 mg / 126,05 g/mol = 0,000789 mol. Como o Na2SO3 contém dois íons SO32- por molécula, o número de íons SO32- em 0,000789 mol de Na2SO3 é 0,000789 mol x 2 = 0,00158 mol. Portanto, existem 0,00158 mol x 6,022 x 10 ^ 23 íons / mol = 9,52 x 10 ^ 20 íons SO32- em 99,6 mg de Na2SO3.
P: Quantos íons de sódio existem em 99,6 mg de Na2SO3? A massa molar do Na2SO3 é 126,05 g/mol.
R: Para calcular o número de íons sódio, primeiro precisamos encontrar o número de moles de Na2SO3: 99,6 mg / 126,05 g/mol = 0,000789 mol. Como cada molécula de Na2SO3 contém dois íons de sódio, o número de íons de sódio em 0,000789 moles de Na2SO3 é 0,000789 mol x 2 = 0,00158 mol. Portanto, existem 0,00158 mol x 6,022 x 10 ^ 23 íons / mol = 9,52 x 10 ^ 20 íons de sódio em 99,6 mg de Na2SO3.
P: Qual é o nome químico do Na2SO3?
R: O nome químico do Na2SO3 é sulfito de sódio.
P: Qual é o nome do composto com a fórmula Na2SO3?
R: O nome do composto com a fórmula Na2SO3 é sulfito de sódio.
