O sulfito de magnésio (MgSO3) é um composto composto por íons magnésio e sulfito. É comumente usado como conservante de alimentos e antioxidante na indústria alimentícia.
| Nome IUPAC | Sulfito de magnésio |
| Fórmula molecular | MgSO3 |
| Número CAS | 7757-88-2 |
| Sinônimos | Sulfonato de magnésio, trióxido de enxofre e magnésio, E-536 |
| InChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriedades do sulfito de magnésio
Fórmula de Sulfito de Magnésio
O sulfito de magnésio tem fórmula química MgSO3, o que indica que é composto por um átomo de magnésio, um átomo de enxofre e três átomos de oxigênio. O íon sulfito é um íon poliatômico com a fórmula SO3 2-, consistindo de um átomo central de enxofre ligado a três átomos de oxigênio. O íon Mg tem carga de +2, enquanto o íon SO3 2- tem carga de -2, tornando o composto eletricamente neutro.
Massa molar de Sulfito de Magnésio
A massa molar do MgSO3 é 104,37 g/mol, o que corresponde à soma das massas atômicas de um átomo de magnésio, um átomo de enxofre e três átomos de oxigênio. Este valor é importante para calcular a quantidade de MgSO3 necessária para uma determinada reação, bem como para determinar a estequiometria das equações químicas.
Ponto de ebulição do sulfito de magnésio
O MgSO3 se decompõe antes de atingir seu ponto de ebulição, portanto não possui um ponto de ebulição específico. Em vez disso, começa a decompor-se em óxido de magnésio e dióxido de enxofre a temperaturas superiores a 700°C. Este processo de decomposição pode ser acelerado pela exposição ao ar ou à umidade, tornando o MgSO3 um composto relativamente instável.
Ponto de fusão de sulfito de magnésio
O ponto de fusão do MgSO3 é de aproximadamente 150°C. A esta temperatura, o composto começa a decompor-se em óxido de magnésio e dióxido de enxofre. O processo de decomposição é exotérmico, ou seja, libera calor. O ponto de fusão do MgSO3 é importante para a compreensão de suas propriedades como sólido, como solubilidade e estrutura cristalina.
Densidade de sulfito de magnésio g/mL
A densidade do MgSO3 varia dependendo da sua forma física, mas geralmente varia de 2,5 a 3,0 g/mL. Este valor é importante para determinar a massa de um determinado volume de MgSO3, bem como para compreender o seu comportamento em solução. A densidade do MgSO3 também pode ser usada para calcular a sua densidade, que é uma medida da sua densidade relativa em comparação com a água.
Peso Molecular de Sulfito de Magnésio
O peso molecular do MgSO3 é 104,37 g/mol. Este valor é importante para a compreensão das propriedades físicas e químicas do composto, bem como para o cálculo da quantidade de MgSO3 necessária para uma determinada reação. O peso molecular do MgSO3 pode ser calculado adicionando os pesos atômicos de um átomo de magnésio, um átomo de enxofre e três átomos de oxigênio.
Estrutura do sulfito de magnésio
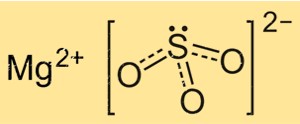
A estrutura do MgSO3 é baseada em uma rede cristalina de íons Mg+2 e íons SO3 2-. Os íons Mg+2 estão rodeados por seis átomos de oxigênio, dispostos de forma octaédrica, enquanto os íons SO3 2- estão ligados aos íons magnésio através de dois átomos de oxigênio. A estrutura cristalina do MgSO3 é importante para a compreensão de suas propriedades físicas e químicas, como solubilidade e reatividade.
Solubilidade do sulfito de magnésio
O MgSO3 é pouco solúvel em água, com solubilidade de aproximadamente 7,5 g/L à temperatura ambiente. Essa baixa solubilidade se deve à estrutura cristalina do composto, que dificulta a penetração e a dissolução das moléculas de água no sólido. O MgSO3 é mais solúvel em soluções ácidas porque o ácido pode reagir com o íon sulfito para formar bissulfito e ácido sulfuroso. A solubilidade do MgSO3 é importante para a compreensão do seu comportamento em solução, bem como para determinar a sua eficácia como conservante alimentar e antioxidante.
| Aparência | Pó branco ou cristais |
| Gravidade Específica | 2,5 – 3,0 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 104,37 g/mol |
| Densidade | 2,5 a 3,0g/ml |
| Ponto de fusão | Cerca de 150°C |
| Ponto de ebulição | Decompõe-se acima de 700°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Ligeiramente solúvel, aproximadamente 7,5 g/L à temperatura ambiente |
| Solubilidade | Mais solúvel em soluções ácidas |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do sulfito de magnésio
O MgSO3 não é considerado uma substância muito perigosa. No entanto, pode causar irritação nos olhos, pele e trato respiratório por contato ou inalação. A ingestão de MgSO3 pode causar irritação gastrointestinal e possivelmente vômito. A exposição prolongada a altas concentrações pode resultar em danos pulmonares ou irritação respiratória. Portanto, é importante manusear o MgSO3 com cuidado, utilizando equipamento de proteção individual adequado e evitando a inalação de poeiras ou fumos. O MgSO3 deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis, como oxidantes fortes, ácidos e bases.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite a inalação de poeira ou vapores. Use equipamento de proteção pessoal apropriado. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2833,29 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade, podendo causar irritação nos olhos, pele e vias respiratórias por contato ou inalação. A ingestão pode causar irritação gastrointestinal e possivelmente vômito. A exposição prolongada a altas concentrações pode resultar em danos pulmonares ou irritação respiratória. |
Métodos de síntese de sulfito de magnésio
O MgSO3 pode ser sintetizado por vários métodos, como a reação de ácido sulfuroso ou gás dióxido de enxofre com óxido de magnésio ou hidróxido de magnésio.
Num método, a reação do óxido de magnésio com água forma hidróxido de magnésio , que então reage com ácido sulfuroso para produzir MgSO3.
Outro método envolve a reação do hidróxido de magnésio com gás dióxido de enxofre na presença de água para formar MgSO3.
Em outro método, a reação do sulfato de magnésio com sulfito de sódio ou sulfito de potássio pode sintetizar MgSO3. Esta reação produz um precipitado de MgSO3, que os pesquisadores podem isolar por filtração e secagem.
A reação do acetato de magnésio com gás dióxido de enxofre na presença de água pode preparar MgSO3. Em seguida, lave e seque o precipitado de MgSO3 resultante.
Esses métodos podem ser usados para produzir MgSO3 para diversas aplicações, incluindo produção de papel e celulose, processamento de alimentos e bebidas e tratamento de água.
Usos do Sulfito de Magnésio
O MgSO3 tem vários usos em diferentes indústrias. Aqui estão alguns de seus usos comuns:
- Tratamento de Água: Usado como eliminador de oxigênio no tratamento de água de caldeiras para evitar corrosão e formação de incrustações.
- Processamento de alimentos e bebidas: Usado como conservante e antioxidante no processamento de alimentos e bebidas para prolongar a vida útil e evitar a deterioração.
- Produção de celulose e papel: Utilizado como agente de branqueamento na indústria de celulose e papel para melhorar o brilho e a cor dos produtos de papel.
- Fabricação têxtil: Utilizado como agente redutor na fabricação têxtil para remover o excesso de oxigênio e melhorar a qualidade do produto acabado.
- Agricultura: Usado como pulverização foliar para melhorar o crescimento das plantas e aumentar o rendimento das colheitas.
- Medicina: Utilizada na medicina tradicional pelas suas propriedades antioxidantes e anti-inflamatórias.
- Cosméticos: Utilizado em cosméticos como emulsificante, estabilizador e ajustador de pH.
- Outras utilizações: Também utilizado na produção de adesivos, tintas e revestimentos, bem como em processos de tratamento de águas residuais.
Questões:
P: Qual é a fórmula do sulfito de magnésio?
R: A fórmula do sulfito de magnésio é MgSO3.
P: Quanto sulfito de magnésio existe em uma amostra de 2,4 moles?
R: Em uma amostra de 2,4 moles de MgSO3, existem 2,4 moles de MgSO3.
P: Qual é a porcentagem em massa de cada elemento em 1 mol de sulfito de magnésio?
R: Em um mol de sulfito de magnésio, a porcentagem em massa de magnésio é 32,44%, o enxofre é 29,44% e o oxigênio é 38,12%.
P: O sulfito de magnésio evita cãibras musculares?
R: Não há evidências científicas que sugiram que o MgSO3 possa parar as cãibras musculares. No entanto, o sulfato de magnésio (sal de Epsom) tem sido utilizado para este fim.
P: Qual é o efeito da adição de sulfito de magnésio às reações?
R: A adição de MgSO3 pode atuar como agente redutor em certas reações, removendo o oxigênio. Também pode atuar como conservante e antioxidante em determinadas aplicações.
P: O sulfito de magnésio é iônico ou molecular?
R: MgSO3 é um composto iônico.
