Sulfito de cálcio (CaSO3) é um composto que contém íons Ca2+ e SO32-. É frequentemente utilizado como conservante de alimentos, antioxidante e purificador de água devido à sua capacidade de remover impurezas e prevenir a deterioração.
| Nome IUPAC | Sulfito de cálcio |
| Fórmula molecular | CaSO3 |
| Número CAS | 10257-55-3 |
| Sinônimos | Sulfito de cálcio; Ácido sulfuroso, sal de cálcio; Ácido sulfuroso de cálcio; Ácido sulfuroso de cálcio; E226 |
| InChI | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriedades do sulfito de cálcio
Fórmula de Sulfito de Cálcio
A fórmula química do sulfito de cálcio é CaSO3. Este composto é composto por um íon Ca2+ e um íon SO32-. O sulfito de cálcio pode ser preparado pela reação do hidróxido de cálcio com ácido sulfuroso. É comumente usado na indústria alimentícia como conservante e antioxidante, bem como purificador de água.
Massa molar de Sulfito de Cálcio
A massa molar do CaSO3 é 120,14 g/mol. Isso pode ser calculado adicionando as massas atômicas de cálcio (40,08 g/mol), enxofre (32,06 g/mol) e três átomos de oxigênio (16,00 g/mol cada).
Ponto de ebulição do sulfito de cálcio
O CaSO3 não possui ponto de ebulição bem definido porque se decompõe antes de atingir seu ponto de ebulição. No entanto, pode ser aquecido a uma temperatura de cerca de 450°C antes que ocorra a decomposição. Isto ocorre porque o CaSO3 é um composto instável e tende a se decompor em sulfato de cálcio e dióxido de enxofre quando aquecido.
Ponto de fusão do sulfito de cálcio
O ponto de fusão do CaSO3 é aproximadamente 1520°C. Esta é a temperatura na qual o composto sólido passa para o estado líquido. O CaSO3 tem uma estrutura cristalina e derrete em altas temperaturas devido às fortes ligações iônicas entre os íons cálcio e sulfito.
Densidade de sulfito de cálcio g/mL
A densidade do CaSO3 é de aproximadamente 2,71 g/mL. Isso significa que um mililitro de CaSO3 tem massa de 2,71 gramas. A alta densidade do CaSO3 se deve à presença do íon cálcio, que possui elevada massa atômica.
Peso molecular do sulfito de cálcio
O peso molecular do CaSO3 é 120,14 g/mol. Isso pode ser calculado adicionando os pesos atômicos de cálcio, enxofre e três átomos de oxigênio no composto. O peso molecular do CaSO3 é importante na determinação de suas propriedades físicas e químicas.
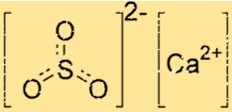
Estrutura do sulfito de cálcio
A estrutura do CaSO3 consiste em um íon Ca2+ e um íon SO32-. O íon cálcio está rodeado por seis átomos de oxigênio, enquanto o íon sulfito possui dois átomos de oxigênio e um átomo de enxofre. O íon Ca2+ e o íon SO32- são mantidos juntos por ligações iônicas, que são fortes forças eletrostáticas de atração entre íons com cargas opostas.
Solubilidade do sulfito de cálcio
O CaSO3 é pouco solúvel em água, com solubilidade de aproximadamente 0,17 g/100 mL à temperatura ambiente. Isto significa que apenas uma pequena quantidade de CaSO3 pode dissolver-se na água e as restantes partículas sólidas permanecerão suspensas na água. A solubilidade do CaSO3 é afetada por fatores como temperatura, pH e presença de outros íons.
| Aparência | Pó branco ou sólido cristalino |
| Gravidade Específica | 2,71 |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 120,14 g/mol |
| Densidade | 2,71g/ml |
| Ponto de fusão | 1520ºC |
| Ponto de ebulição | Decompõe-se antes de atingir o ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Ligeiramente solúvel, aprox. 0,17 g/100 mL à temperatura ambiente. |
| Solubilidade | Insolúvel em álcool e éter |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 1,91 |
| pH | Ligeiramente básico (pH 8-9 quando dissolvido em água) |
Segurança e perigos do sulfito de cálcio
O CaSO3 é geralmente considerado seguro para uso em aplicações de tratamento de alimentos e água. No entanto, como qualquer produto químico, pode representar certos perigos se não for manuseado corretamente. O CaSO3 é irritante para a pele e os olhos e pode causar irritação respiratória se inalado. A ingestão de grandes quantidades de CaSO3 pode causar náuseas, vômitos e diarreia. Ao manusear CaSO3, devem ser tomadas precauções de segurança adequadas, como uso de luvas e óculos de proteção. Deve-se procurar atendimento médico imediatamente caso entre em contato com CaSO3 na pele, nos olhos ou se o ingerir. Também é importante seguir os procedimentos adequados de armazenamento e descarte de CaSO3 para minimizar riscos potenciais.
| Símbolos de perigo | Nenhum atribuído |
| Descrição de segurança | Evite o contato com os olhos, pele e roupas. Use luvas e óculos de proteção durante o manuseio. Em caso de contato, lave as áreas afetadas com água. Se ingerido, procure atendimento médico imediatamente. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 283210 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | O sulfito de cálcio é considerado não tóxico em baixas concentrações, mas pode causar irritação gastrointestinal e outros efeitos à saúde em altas doses. |
Métodos de síntese de sulfito de cálcio
A reação do ácido sulfuroso com hidróxido de cálcio pode sintetizar CaSO3. A reação produz CaSO3 e água como subprodutos.
Outro método envolve a reação do carbonato de cálcio com ácido sulfuroso, que produz CaSO3, água e dióxido de carbono. Normalmente, os químicos realizam a reação em solução aquosa à temperatura ambiente ou ligeiramente superior.
Em outro método, a reação do óxido de cálcio com o dióxido de enxofre e a adição de água ao produto resultante produz CaSO3.
Em ambientes industriais, a absorção de dióxido de enxofre numa suspensão de hidróxido de cálcio geralmente produz CaSO3. Este processo produz uma mistura de CaSO3 e sulfato de cálcio, que pode ser separada por filtração ou outros métodos. O CaSO3 resultante pode ser usado em diversas aplicações, incluindo tratamento de água e como conservante de alimentos.
No geral, existem vários métodos para sintetizar CaSO3, cada um com suas próprias vantagens e limitações, dependendo da aplicação específica e da pureza desejada do produto final.
Usos do Sulfito de Cálcio
O CaSO3 tem vários usos em diferentes indústrias devido às suas propriedades únicas. Alguns usos comuns de CaSO3 incluem:
- Tratamento de Água: Frequentemente usado como agente de tratamento de água para remover impurezas e desinfetar a água. Pode remover com eficácia cloro, metais pesados e outros contaminantes da água.
- Preservação de Alimentos: Usado como conservante de alimentos para evitar a deterioração e prolongar a vida útil dos produtos alimentícios. Comumente utilizado na produção de alimentos enlatados e engarrafados, bem como na elaboração de vinhos e cervejas.
- Indústria química: Utilizado na indústria química como agente redutor e na produção de ácido sulfúrico.
- Construção: Usado como componente de materiais de construção, como drywall e cimento.
- Indústria agrícola: Utilizado na agricultura para tratar o solo e prevenir doenças de plantas.
- Aplicações Médicas: Também usado em aplicações médicas como antioxidante e como tratamento para certas condições médicas.
Questões:
P: Qual é a fórmula do sulfito de cálcio?
R: A fórmula do sulfito de cálcio é CaSO3.
P: Qual é a condição do sulfito de cálcio?
R: O CaSO3 é um sólido à temperatura ambiente.
P: Quantos gramas de cálcio existem em 3,36 gramas de CaSO3?
R: Existem aproximadamente 1,14 gramas de cálcio presentes em 3,36 gramas de CaSO3.
P: O que acontece quando você adiciona carbonato de cálcio ao ácido clorídrico e ao sulfito de sódio?
R: Quando o carbonato de cálcio é adicionado ao ácido clorídrico e ao sulfito de sódio, ocorre uma reação que produz CaSO3, água, dióxido de carbono e cloreto de sódio.
P: O sulfito de cálcio se dissolve na água?
R: Sim, o CaSO3 é ligeiramente solúvel em água.
P: Existe sulfito de cálcio na água da cidade?
R: O CaSO3 não é comumente encontrado na água urbana, mas pode ser usado em processos de tratamento de água para remover impurezas.
P: O CaSO3 pode ser removido da água potável?
R: Sim, o CaSO3 pode ser removido da água potável por vários métodos, como filtração, osmose reversa ou tratamento químico.
P: O que CaSO3 e HCl produzem?
R: Quando CaSO3 é adicionado ao ácido clorídrico, ocorre uma reação que produz cloreto de cálcio, dióxido de enxofre gasoso e água.
