O sulfito de sódio, também conhecido como Na2SO3, é um pó cristalino branco comumente usado como conservante na indústria alimentícia e como agente redutor em fotografia.
| Nome IUPAC | Sulfito dissódico |
| Fórmula molecular | Na2SO3 |
| Número CAS | 7757-83-7 |
| Sinônimos | Sulfito de sódio; Sulfito dissódico; Ácido sulfuroso, sal dissódico; Sulfonato de sódio; Sulfito de Sódio |
| InChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Propriedades do sulfito de sódio
Fórmula de Sulfito de Sódio
A fórmula química do sulfito de sódio é Na2SO3. É composto por dois íons Na+ e um íon SO32-. Os íons Na+ carregam uma carga positiva enquanto o íon SO32- carrega uma carga negativa. O sulfito de sódio é um composto iônico que forma um pó cristalino branco.
Massa molar de Sulfito de Sódio
A massa molar do Na2SO3 é 126,04 g/mol. Este valor é obtido somando as massas atômicas de cada elemento do composto. As massas atômicas de sódio, enxofre e oxigênio são 22,99 g/mol, 32,06 g/mol e 15,99 g/mol, respectivamente. A massa molar é um parâmetro importante utilizado em cálculos estequiométricos e também pode ser utilizada para determinar a quantidade de substância presente em uma amostra.
Ponto de ebulição do sulfito de sódio
O Na2SO3 tem um ponto de ebulição relativamente alto de 1650°C. Isto se deve às fortes ligações iônicas entre os íons Na+ e SO32-, que requerem uma grande quantidade de energia para serem quebradas. O ponto de ebulição é a temperatura na qual uma substância passa da fase líquida para a fase gasosa. A esta temperatura, a pressão de vapor do líquido é igual à pressão atmosférica.
Ponto de fusão do sulfito de sódio
O ponto de fusão do Na2SO3 é 33,4°C. Este ponto de fusão relativamente baixo é devido às fracas forças intermoleculares entre as moléculas de Na2SO3. Quando aquecido, as forças intermoleculares são superadas e o Na2SO3 sólido derrete em líquido.
Densidade de sulfito de sódio g/mL
A densidade do Na2SO3 é 2,633 g/mL. A densidade é definida como a massa de uma substância por unidade de volume. A alta densidade do Na2SO3 se deve à sua natureza iônica e à presença de dois íons sódio por íon sulfito em sua estrutura.
Peso molecular do sulfito de sódio
O peso molecular do Na2SO3 é 126,04 g/mol. Este valor é obtido somando os pesos atômicos de cada elemento do composto. O peso molecular é um parâmetro importante utilizado em cálculos estequiométricos e também pode ser utilizado para determinar a quantidade de substância presente em uma amostra.
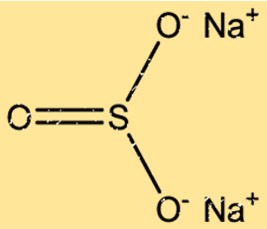
Estrutura do sulfito de sódio
O Na2SO3 tem uma estrutura cristalina com dois íons Na+ e um íon SO32- dispostos em um padrão repetitivo. Os íons Na+ estão dispostos em uma rede cúbica de face centrada, enquanto os íons SO32- ocupam os sítios octaédricos da rede. As ligações iônicas entre os íons Na+ e SO32- resultam em uma estrutura cristalina estável.
Solubilidade do sulfito de sódio
O Na2SO3 é altamente solúvel em água, com solubilidade de 22,4 g/100 mL a 20°C. Essa alta solubilidade se deve à natureza iônica do Na2SO3, que permite que ele se dissocie em água e forme íons Na+ e SO32-. A solubilidade do Na2SO3 em água aumenta com a temperatura, à medida que a energia cinética das moléculas aumenta e mais íons são liberados na solução.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 2,633g/cm³ |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 126,04 g/mol |
| Densidade | 2.633g/mL |
| Ponto de fusão | 33,4ºC |
| Ponto de ebulição | 1650°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em glicerol, ligeiramente solúvel em etanol |
| Pressão de vapor | 0mmHg a 20°C |
| Densidade do vapor | Não aplicável |
| pKa | 6h35 |
| pH | 8,3 – 9,5 (solução a 5%) |
Segurança e perigos do sulfito de sódio
O Na2SO3 pode ser perigoso se não for manuseado corretamente. Pode causar irritação na pele e nos olhos e, se ingerido, pode causar náuseas, vômitos e dores abdominais. Também pode causar irritação respiratória se inalado. Além disso, o Na2SO3 pode reagir com outros produtos químicos para produzir gases tóxicos, como o dióxido de enxofre, que podem ser prejudiciais à saúde. Portanto, é importante usar equipamento de proteção individual adequado ao manusear o Na2SO3 e evitar a exposição dos olhos, pele e membranas mucosas. O Na2SO3 também deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis.
| Símbolos de perigo | Xi,O |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Em caso de contato, lavar imediatamente com água em abundância e consultar um médico. Não ingira. Evite a inalação de poeira. Use equipamento de proteção pessoal apropriado. Manter afastado do calor, faíscas e chamas. |
| UM ID | 1384 |
| Código SH | 283210 |
| Classe de perigo | 8 – Substâncias corrosivas |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato) – 1.640 mg/kg; LC50 (inalação, rato) – 63 mg/m³ |
Métodos para a síntese de sulfito de sódio
Vários métodos podem sintetizar Na2SO3.
Um método comum é reagir o hidróxido de sódio com o gás dióxido de enxofre na presença de água. A reação produz Na2SO3 e água como subprodutos.
Em outro método, o carbonato de sódio reage com o gás dióxido de enxofre na presença de água, produzindo Na2SO3 e gás dióxido de carbono. Para aumentar o rendimento de Na2SO3, esta reação pode ser realizada em altas temperaturas e pressões.
A reação do bissulfito de sódio com hidróxido de sódio pode sintetizar Na2SO3. Esta reação produz Na2SO3, água e cloreto de sódio como subprodutos.
Outro método envolve a reação de sulfeto de sódio com gás dióxido de enxofre na presença de água para produzir Na2SO3 e gás sulfeto de hidrogênio.
Para sintetizar Na2SO3, o sulfato de sódio deve ser tratado com gás dióxido de enxofre na presença de um agente redutor, como o carvão ativado. Esta reação produz Na2SO3 e dióxido de carbono.
Cada um desses métodos tem suas próprias vantagens e desvantagens, e a escolha do método depende de vários fatores, como o rendimento desejado, a pureza e o custo do produto, e a disponibilidade de reagentes e equipamentos.
Usos do sulfito de sódio
O Na2SO3 tem vários usos industriais e comerciais importantes, incluindo:
- Fotografia: Utilizado como agente redutor e conservante em soluções de revelação fotográfica. Isso ajuda a estabilizar a imagem e evitar o desbotamento.
- Tratamento de Água: Utilizado para remover cloro e excesso de oxigênio da água em estações de tratamento de água industriais e municipais. Também ajuda a prevenir a corrosão de tubulações e equipamentos.
- Indústria de papel e celulose: utilizada na produção de papel e celulose para branquear e reduzir o teor de lignina da celulose. Isso ajuda a melhorar a qualidade e a cor do papel.
- Indústria alimentícia: Utilizado como conservante e antioxidante na indústria alimentícia. Ajuda a prevenir a descoloração e deterioração de alimentos, como frutas secas, vinho e cerveja.
- Indústria Têxtil: Utilizado como agente redutor e agente branqueador na indústria têxtil para remover o excesso de corante e melhorar a solidez da cor dos tecidos.
- Indústria química: Utilizado como agente redutor em diversas reações químicas, como na produção de corantes, produtos farmacêuticos e polímeros.
- Outros usos: Também utilizado na fabricação de detergentes, produtos de couro e produtos de higiene pessoal, como tinturas de cabelo e xampus.
Questões:
P: O que é sulfito de sódio normal em uma caldeira?
R: A concentração normal de Na2SO3 em uma caldeira é geralmente entre 20 e 40 partes por milhão (ppm), dependendo da pressão operacional e de outros fatores.
P: Como você equilibra o dióxido de enxofre com o hidróxido de sódio para formar sulfito de sódio e água?
R: Para equilibrar a equação da reação do dióxido de enxofre e do hidróxido de sódio para formar Na2SO3 e água, você deve garantir que haja um número igual de átomos de cada elemento nos dois lados da equação. A equação balanceada seria SO2 + 2NaOH → Na2SO3 + H2O.
P: O que é sulfito de sódio?
R: Na2SO3 é um composto cristalino branco comumente usado em diversas aplicações industriais e comerciais, como fotografia, tratamento de água, produção de papel e preservação de alimentos.
P: Qual é a fórmula do sulfito de sódio?
R: A fórmula do sulfito de sódio é Na2SO3.
P: É à base de sulfito de sódio?
R: Na2SO3 é um sal de base forte (hidróxido de sódio) e ácido fraco (ácido sulfuroso) e, portanto, possui propriedades básicas. No entanto, geralmente não é considerado uma base sólida.
P: O sulfito de sódio é estável na água?
R: O Na2SO3 é relativamente estável em água, mas pode se decompor gradualmente ao longo do tempo, especialmente na presença de oxigênio ou outros agentes oxidantes.
P: O sulfito de sódio é inflamável?
R: O Na2SO3 não é inflamável, mas pode reagir com certos agentes oxidantes para liberar dióxido de enxofre, que é irritante respiratório e pode ser inflamável.
P: Onde comprar sulfito de sódio localmente?
R: O Na2SO3 pode ser adquirido de empresas fornecedoras de produtos químicos, fornecedores industriais e alguns varejistas especializados. Também pode estar disponível em algumas lojas de ferragens locais ou centros de reforma residencial.
P: Quais alimentos contêm sulfito de sódio?
R: O Na2SO3 é comumente usado como conservante em alimentos como vinho, cerveja, frutas secas e algumas carnes processadas.
P: Qual produto é igual ao sulfito de sódio?
R: O bissulfito de sódio é um composto semelhante que pode ser usado como substituto do Na2SO3 em algumas aplicações. Outros substitutos podem incluir metabissulfito de sódio ou metabissulfito de potássio.
