O tiossulfato de sódio é um composto químico com a fórmula Na2S2O3. É comumente usado como fixador em processamento fotográfico e como agente redutor em certas reações químicas.
| Nome IUPAC | Tiossulfato de sódio |
| Fórmula molecular | Na2S2O3 |
| Número CAS | 7772-98-7 |
| Sinônimos | Hipossulfito de sódio, tiossulfato de sódio, sal dissódico de ácido tiossulfúrico, tiossulfato de sódio pentahidratado |
| InChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriedades do tiossulfato de sódio
Fórmula de tiossulfato de sódio
A fórmula química do tiossulfato de sódio é Na2S2O3. Consiste em dois íons Na+ e dois íons S2O3 2-. A fórmula mostra os tipos e o número de átomos presentes em uma molécula do composto.
Massa molar de tiossulfato de sódio
A massa molar de Na2S2O3 é 158,11 g/mol. É calculado somando as massas atômicas de todos os átomos presentes em um mol do composto. Este valor é útil para determinar a quantidade de Na2S2O3 necessária para uma reação específica ou para calcular a concentração de uma solução.
Ponto de ebulição do tiossulfato de sódio
O Na2S2O3 não tem ponto de ebulição porque se decompõe antes de atingir o ponto de ebulição. À pressão normal, decompõe-se entre 48 e 55°C, libertando dióxido de enxofre. Esta propriedade o torna inadequado para aplicações em altas temperaturas.
Ponto de fusão do tiossulfato de sódio
O ponto de fusão do Na2S2O3 é 48,3°C. Esta é a temperatura na qual o composto sólido muda de estado para líquido. Seu ponto de fusão é relativamente baixo em comparação com outros sais inorgânicos, facilitando sua dissolução em água.
Densidade de tiossulfato de sódio g/mL
A densidade do Na2S2O3 é 1,667 g/mL. Este valor refere-se à massa da substância por unidade de volume. É maior que a densidade da água, o que significa que o Na2S2O3 afunda na água.
Peso molecular do tiossulfato de sódio
O peso molecular do Na2S2O3 é 158,11 g/mol. É a soma dos pesos atômicos de todos os átomos presentes em uma molécula do composto. O peso molecular é útil para determinar a quantidade de Na2S2O3 necessária para uma reação específica ou para calcular a concentração de uma solução.
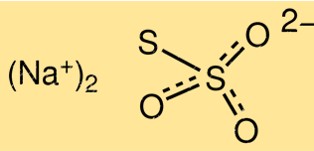
Estrutura do tiossulfato de sódio
A estrutura do Na2S2O3 consiste em dois íons S2O3 2-, ligados a um íon sódio, Na+. A molécula tem uma forma de pirâmide trigonal com um ângulo de ligação de aproximadamente 103 graus. O íon tiossulfato possui uma ligação enxofre-enxofre e duas ligações enxofre-oxigênio.
Solubilidade do tiossulfato de sódio
Na2S2O3 é muito solúvel em água. A solubilidade do Na2S2O3 em água aumenta com a temperatura, com aproximadamente 70 g do composto dissolvendo-se em 100 ml de água a 25°C. Também é solúvel em glicerol e ligeiramente solúvel em álcool. Sua solubilidade o torna útil em diversas aplicações, como processamento fotográfico e tratamentos médicos.
| Aparência | Pó cristalino branco |
| Gravidade Específica | 1.667g/mL |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 158,11 g/mol |
| Densidade | 1.667g/mL |
| Ponto de fusão | 48,3ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em glicerol e ligeiramente solúvel em álcool |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro (pH 7) |
Segurança e perigos do tiossulfato de sódio
O Na2S2O3 é geralmente considerado seguro quando manuseado corretamente. No entanto, pode ser prejudicial se ingerido, inalado ou se entrar em contato com os olhos ou a pele. O composto pode causar irritação na pele e nos olhos e a exposição prolongada pode resultar em dermatite. A ingestão de Na2S2O3 pode causar desconforto gastrointestinal, como náuseas e vômitos. É importante usar equipamento de proteção individual adequado, como luvas e óculos de segurança, ao trabalhar com Na2S2O3. Se exposta, a área afetada deve ser lavada com água e procurar atendimento médico, se necessário.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Evite o contato com os olhos, pele e roupas. Não ingira. Use equipamento de proteção pessoal apropriado. |
| Números de identificação da ONU | UN3077 |
| Código SH | 2832.3010.00 |
| Classe de perigo | 9 |
| Grupo de embalagem | III |
| Toxicidade | Baixa toxicidade; O LD50 (oral, rato) é 6.200 mg/kg |
Métodos para a síntese de tiossulfato de sódio
Vários métodos podem sintetizar Na2S2O3.
Um método comum é reagir o sulfito de sódio com enxofre na presença de uma solução alcalina. Outro método envolve a reação de sulfito de sódio com dióxido de enxofre sob pressão.
Um método para preparar Na2S2O3 é dissolver o enxofre em uma solução quente de sulfito de sódio e hidróxido de sódio . A solução esfria e alguém a filtra para obter um produto sólido.
Neste método, o dióxido de enxofre reage com hidróxido de sódio para produzir sulfito de sódio e, em seguida, reage com enxofre elementar para produzir Na2S2O3.
Para produzir Na2S2O3, o ácido sulfúrico pode reagir com sulfito de sódio, depois aquecer a solução resultante e adicionar enxofre. O sulfito de sódio irá então reagir com o enxofre para formar Na2S2O3.
Outro método envolve a reação de hidróxido de sódio com enxofre, seguida pela adição de sulfito de sódio para formar Na2S2O3.
Usos do tiossulfato de sódio
O Na2S2O3 tem uma ampla gama de utilizações em diversas indústrias e aplicações, incluindo:
- Fotografia: Usado como agente fixador para remover haleto de prata não exposto de impressões fotográficas e filmes.
- Tratamento de Água: Utilizado para desclorar a água, neutralizando o cloro e prevenindo seus efeitos nocivos à vida aquática.
- Aplicações médicas: Utilizado no tratamento de intoxicação por cianeto porque reage com o cianeto para formar tiocianato, que é menos tóxico e pode ser excretado do corpo.
- Aplicações Industriais: Utilizado como agente redutor em processos químicos e como conservante em têxteis, couro e papel.
- Química Analítica: Utilizada como titulante na análise de diversos metais, como cobre e arsênico.
- Indústria de alimentos e bebidas: utilizado como conservante de alimentos para prevenir a descoloração e como intensificador de sabor.
- Horticultura: Utilizado para neutralizar os efeitos do cloro na água utilizada na irrigação das plantas.
Questões:
P: Para que é usado o tiossulfato de sódio?
R: O Na2S2O3 tem uma ampla gama de aplicações, incluindo fotografia, tratamento de água, tratamentos médicos, processos industriais, química analítica, preservação de alimentos e bebidas e horticultura.
P: Como fazer tiossulfato de sódio?
R: O Na2S2O3 pode ser sintetizado pela reação do sulfito de sódio com enxofre ou dióxido de enxofre na presença de uma solução alcalina. Outros métodos envolvem a reação do hidróxido de sódio com enxofre ou dióxido de enxofre para produzir sulfito de sódio, que então reage com o enxofre para produzir Na2S2O3.
P: O que é tiossulfato de ouro e sódio?
R: Ouro Na2S2O3 é um composto complexo formado pela reação de cloreto de ouro e Na2S2O3. É usado em folheamento de ouro e química analítica para detectar e quantificar ouro.
P: Onde comprar tiossulfato de sódio?
R: O Na2S2O3 pode ser adquirido de fornecedores de produtos químicos, empresas de fornecimento de laboratório e varejistas on-line.
P: Onde posso encontrar tiossulfato de sódio?
R: O Na2S2O3 pode ser encontrado em uma variedade de produtos, incluindo produtos químicos fotográficos, produtos para tratamento de água e tratamentos médicos.
P: Qual é o número de oxidação do enxofre no Na2S2O3?
R: O número de oxidação do enxofre em Na2S2O3 é +2 no íon tiossulfato (S2O3 ^ 2-) e +6 no íon sulfato (SO4 ^ 2-).
P: Como encontrar o peso de Cu a partir da titulação de Na2S2O3?
R: O peso do Cu pode ser calculado a partir do volume e da molaridade da solução de Na2S2O3 utilizada na titulação, utilizando a equação química balanceada para a reação entre Cu e Na2S2O3.
P: Como você saberá quando uma quantidade estequiométrica de Na2S2O3 foi adicionada?
R: Uma quantidade estequiométrica de Na2S2O3 foi adicionada quando o ponto final da reação é atingido, conforme indicado por uma mudança na cor ou outra propriedade física ou química.
P: Se 5 gotas de KI 0,15 M forem adicionadas a 40 gotas de Na2S2O3, qual é a concentração final de KI?
R: A concentração final de KI não pode ser determinada sem informações adicionais, como o volume ou concentração da solução de Na2S2O3.
P: Como encontrar a molaridade de Na2S2O3?
R: A molaridade do Na2S2O3 pode ser calculada a partir da massa da amostra e do volume e concentração da solução utilizada para dissolvê-la, utilizando a fórmula Molaridade = mols de soluto/volume de solução em litros.
