O nitrito de potássio (KNO2) é um composto químico comumente usado como conservante de alimentos. É conhecido por inibir o crescimento de bactérias e prevenir a deterioração de carnes e outros alimentos.
| Nome IUPAC | Nitrito de Potássio |
| Fórmula molecular | KNO2 |
| Número CAS | 7758-09-0 |
| Sinônimos | Ácido nitroso, sal de potássio; salitre(III); ácido nitroso, composto. com sal de potássio (1:1); E249 |
| InChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Propriedades do nitrito de potássio
Fórmula de nitrito de potássio
A fórmula química do nitrito de potássio é KNO2. Representa a composição do composto em termos de seus átomos constituintes. A fórmula do nitrito de potássio é usada para calcular sua massa molar e peso molecular.
Massa molar de nitrito de potássio
A massa molar do KNO2 é 85,103 g/mol. É derivado da soma das massas atômicas de potássio (39,10 g/mol), nitrogênio (14,01 g/mol) e dois átomos de oxigênio (2 x 16,00 g/mol). A massa molar do KNO2 é essencial para determinar quanto da substância está presente em uma determinada massa ou volume.
Ponto de ebulição do nitrito de potássio
O ponto de ebulição do KNO2 é 320°C (608°F). A esta temperatura, o composto muda de uma fase líquida para uma fase gasosa. O ponto de ebulição do KNO2 depende de vários fatores, como pressão e pureza.
Ponto de fusão do nitrito de potássio
O ponto de fusão do KNO2 é 441°C (826°F). A esta temperatura, o composto sólido se transforma na fase líquida. O ponto de fusão do KNO2 é um parâmetro crucial para determinar sua adequação para diversas aplicações, como preservação de alimentos e medicamentos.
Densidade de nitrito de potássio g/mL
A densidade do KNO2 é 1,915 g/mL à temperatura ambiente. A densidade de uma substância é definida como a massa da substância por unidade de volume. A densidade do KNO2 desempenha um papel importante na determinação de suas propriedades físicas, como solubilidade e reatividade química.
Peso molecular do nitrito de potássio
O peso molecular do KNO2 é 85,103 g/mol. É um parâmetro crucial para determinar a estequiometria de uma reação envolvendo KNO2. O peso molecular do KNO2 também é usado para determinar suas propriedades físicas e químicas.
Estrutura do nitrito de potássio
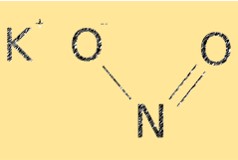
KNO2 tem uma fórmula molecular de KNO2. Possui estrutura iônica, com cátions potássio (K+) e ânions nitrito (NO2-). O íon nitrito possui geometria molecular curva, com ângulo de ligação de aproximadamente 115°. A estrutura do KNO2 é essencial na determinação de suas propriedades químicas, como solubilidade e reatividade.
Solubilidade do nitrito de potássio
O KNO2 é muito solúvel em água, com solubilidade de aproximadamente 710 g/L a 20°C. A solubilidade do KNO2 depende de vários fatores como temperatura, pressão e presença de outras substâncias. A solubilidade do KNO2 é um parâmetro crucial para determinar sua adequação para diversas aplicações, como preservação de alimentos e medicamentos.
| Aparência | Sólido cristalino branco a amarelado |
| Gravidade Específica | 1.915 |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 85,103 g/mol |
| Densidade | 1,915g/mL |
| Ponto de fusão | 441°C (826°F) |
| Ponto de ebulição | 320°C (608°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel (710 g/L a 20°C) |
| Solubilidade | Solúvel em etanol, ligeiramente solúvel em amônia |
| Pressão de vapor | 0,0038 mmHg a 25°C |
| Densidade do vapor | 2,96 (ar = 1) |
| pKa | 3,35 |
| pH | 5-8 (solução a 5%) |
Segurança e perigos do nitrito de potássio
O KNO2 pode ser perigoso se manuseado incorretamente. É prejudicial se ingerido ou inalado e pode causar irritação nos olhos, pele e sistema respiratório. A exposição prolongada ou repetida ao KNO2 pode causar metemoglobinemia, uma condição que reduz a capacidade do sangue de transportar oxigênio. O KNO2 também é um forte agente oxidante e pode reagir violentamente com materiais combustíveis, causando incêndio ou explosão. Medidas de segurança adequadas, como o uso de equipamentos de proteção, ventilação adequada e armazenamento seguro, devem ser seguidas ao manusear KNO2. Se ingerido ou inalado, procure atendimento médico imediatamente.
| Símbolos de perigo | Xn |
| Descrição de segurança | S22, S24/25 |
| Números de identificação da ONU | ONU 1488 |
| Código SH | 2834.29.10 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | III |
| Toxicidade | Nocivo se ingerido ou inalado, pode causar metemoglobinemia |
Métodos de síntese de nitrito de potássio
O hidróxido de potássio (KOH) reage com o ácido nitroso (HNO2) para sintetizar KNO2. A reação produz KNO2 e água (H2O) como subprodutos. A indústria normalmente utiliza este método para fabricar grandes quantidades de KNO2.
A equação da reação é:
2 KOH + HNO2 → KNO2 + 2 H2O
Outro método para sintetizar KNO2 é reagir o carbonato de potássio (K2CO3) com óxido nítrico (NO). A reação produz KNO2, dióxido de carbono (CO2) e nitrogênio (N2) como subprodutos. A obtenção de óxido nítrico é difícil e cara, tornando esse método menos utilizado.
A equação da reação é:
2 K2CO3 + 2 NÃO → 2 KNO2 + 2 CO2 + N2
O KNO2 pode ser obtido oxidando o KNO3 usando um agente redutor como SO2 ou FeSO4.
A reação produz KNO2, água e a forma reduzida do agente redutor como subprodutos. Os cientistas usam este método com menos frequência e geralmente o reservam para sínteses laboratoriais em pequena escala.
A equação para a reação com dióxido de enxofre é:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Usos do nitrito de potássio
O KNO2 possui diversas aplicações industriais e laboratoriais devido às suas propriedades químicas. Alguns dos usos comuns do KNO2 são:
- Preservação de Alimentos: Usado como conservante em carnes curadas para prevenir o crescimento de bactérias nocivas e prolongar sua vida útil.
- Indústria Química: Utilizado como intermediário na produção de diversos produtos químicos, como ácido nitroso, compostos de diazônio e nitritos orgânicos.
- Agricultura: Utilizado como fertilizante e condicionador de solo devido à sua alta solubilidade em água e capacidade de liberar nitrogênio.
- Reagente de Laboratório: Utilizado como reagente em diversas aplicações laboratoriais, como detecção de aminas primárias e preparação de sais de diazônio.
- Uso medicinal: Usado no tratamento de intoxicação por cianeto porque reage com íons cianeto para formar cianmetemoglobina não tóxica.
- Fotografia: Usado como aditivo em reveladores fotográficos para melhorar a qualidade e clareza das imagens reveladas.
- Indústria do vidro: Usado na indústria do vidro como agente de branqueamento para remover colorações indesejadas de produtos de vidro.
Questões:
O que é nitrito de potássio?
R: KNO2 é um composto inorgânico comumente usado em diversas aplicações industriais e laboratoriais.
P: Qual é a fórmula do nitrito de potássio?
R: A fórmula química do nitrito de potássio é KNO2.
P: Que sal é produzido quando o NH4OH reage com o HNO3? KNO2, NaNO3, NH4NO3 ou NH4NO2?
R: Quando NH4OH reage com HNO3, o sal produzido é NH4NO3.
P: O KNO2 é um ácido ou uma base?
R: KNO2 é um composto básico.
P: Qual é o nome do composto com a fórmula KNO2?
R: O nome do composto com a fórmula KNO2 é nitrito de potássio.
P: O KNO2 é uma base fraca?
R: KNO2 é considerado uma base fraca.
P: O KNO2 é ácido ou básico?
R: O KNO2 é de natureza básica e pode atuar como um agente redutor suave.
